Кислородсодержащие классы органических соединений. Гидроксисоединения. Карбонильные соединения. (Лекция 3) презентация
Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания о строении, номенклатуре и реакционной способности спиртов, фенолов и карбонильных соединений.
- 3. ПЛАН ЛЕКЦИИ Спирты Фенолы Альдегиды и кетоны
- 4. Гидроксисоединения Гидроксисоединения – это вещества, которые в своем составе содержат OH-группы. К ним относят спирты, фенолы,
- 5. Спирты – это гидроксисоединения, в молекулах которых OH-группы связаны с насыщенным атомом углерода, находящимся в состоянии
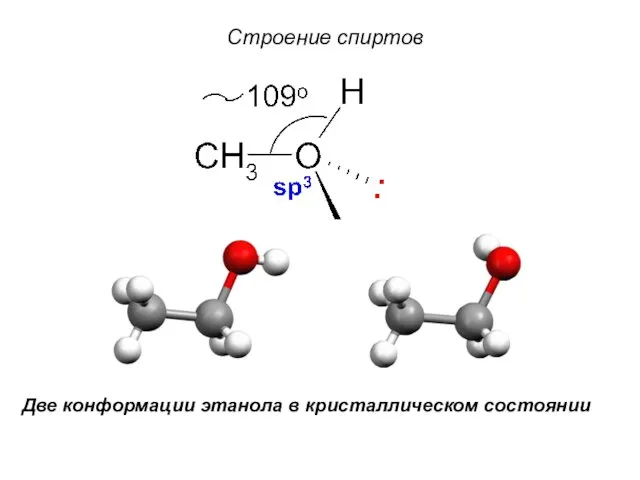
- 6. Строение спиртов Две конформации этанола в кристаллическом состоянии
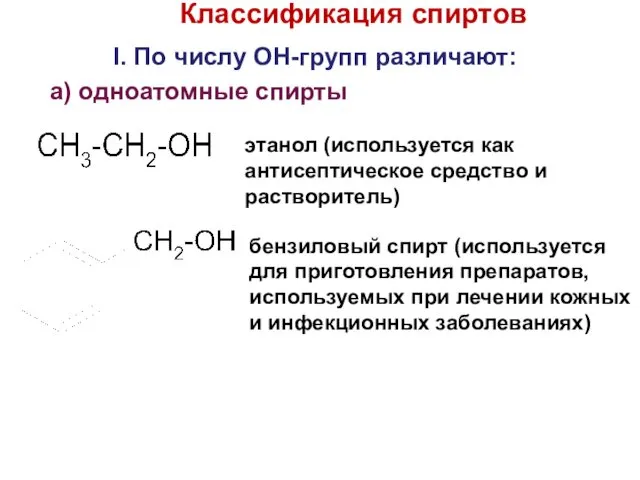
- 7. Классификация спиртов I. По числу OH-групп различают: a) одноатомные спирты этанол (используется как антисептическое средство и
- 8. Спирты b) многоатомные спирты (содержат 2 и более гидроксильные группы) Глицерин (является структурным компонентом липидов) Диольный
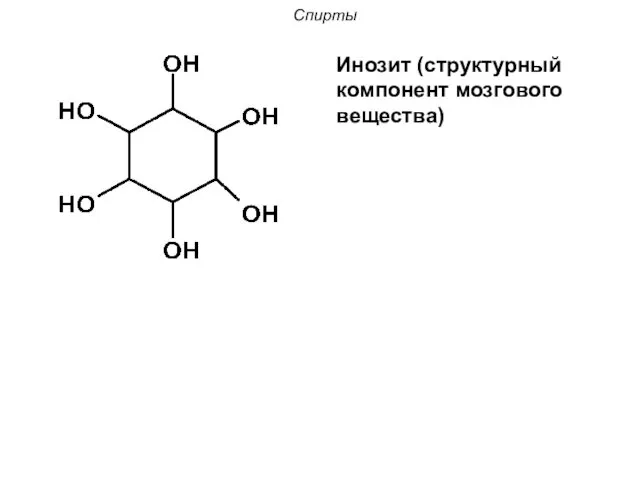
- 9. Спирты Инозит (структурный компонент мозгового вещества)
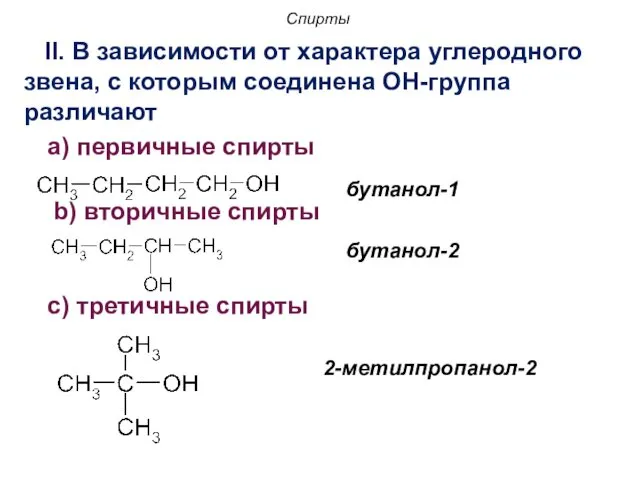
- 10. Спирты II. В зависимости от характера углеродного звена, с которым соединена OH-группа различают a) первичные спирты
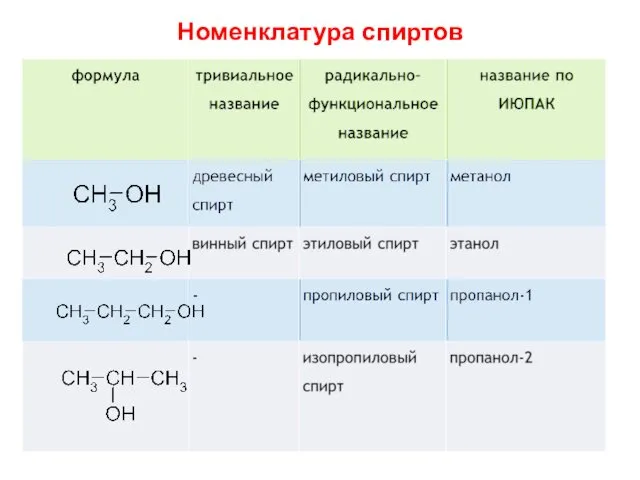
- 11. Номенклатура спиртов
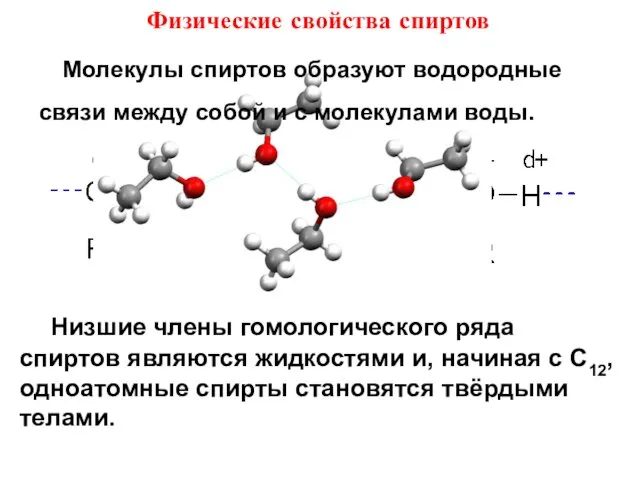
- 12. Физические свойства спиртов Низшие члены гомологического ряда спиртов являются жидкостями и, начиная с C12, одноатомные спирты
- 13. Спирты Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол
- 14. Спирты Метиловый спирт считается самым ядовитым спиртом. Прием внутрь вызывает слепоту или смерть. НЕ ПЕЙ МЕТИЛОВЫЙ
- 15. Общее действие этанола характеризуется угнетением функции ЦНС, а возникающие на начальных этапах эйфория и возбуждение являются
- 16. Злоупотребление этанолом ведёт к развитию алкоголизма, деградации личности, психическим расстройствам и соматическим заболеваниям. Спирты
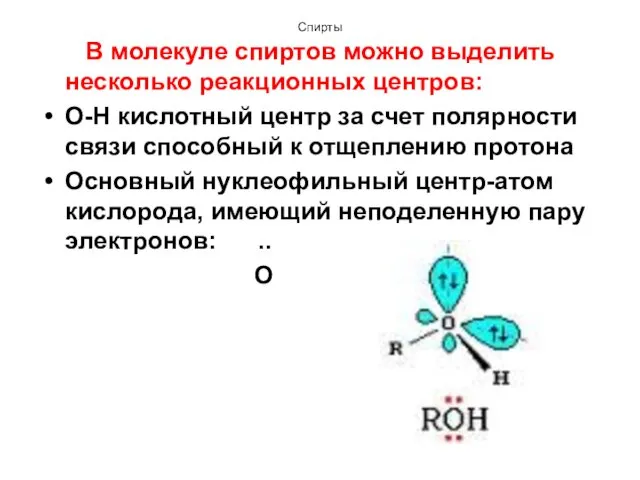
- 17. Спирты В молекуле спиртов можно выделить несколько реакционных центров: О-Н кислотный центр за счет полярности связи
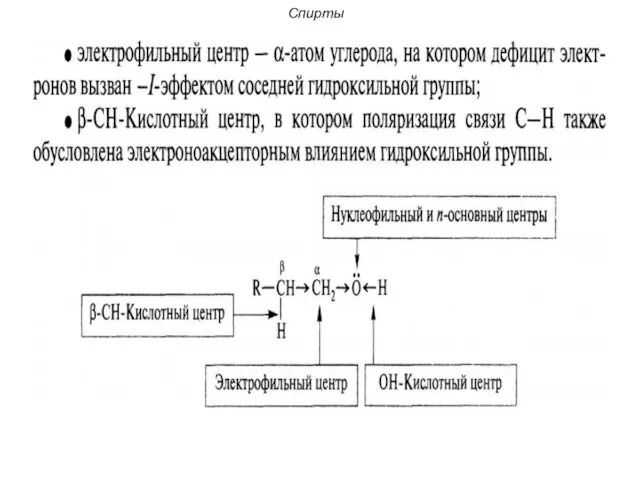
- 18. Спирты
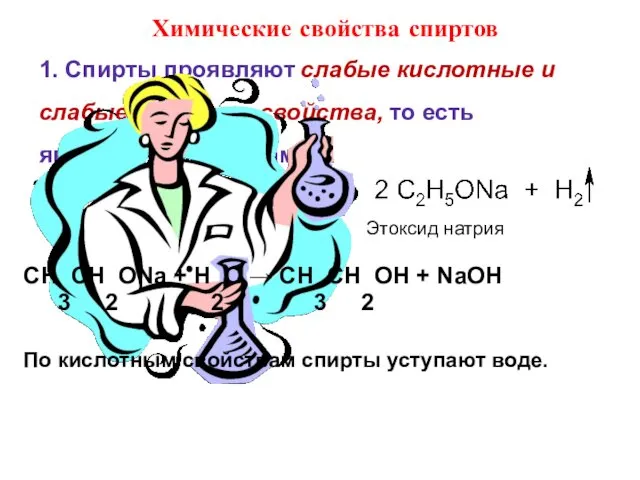
- 19. Химические свойства спиртов 1. Спирты проявляют слабые кислотные и слабые основные свойства, то есть являются амфолитами.
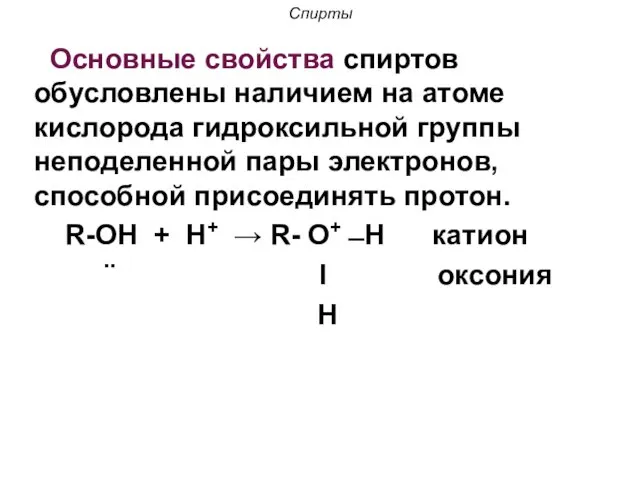
- 20. Спирты Основные свойства спиртов обусловлены наличием на атоме кислорода гидроксильной группы неподеленной пары электронов, способной присоединять
- 21. Спирты 2. Реакции окисления: внутри организма (in vivo) эти реакции протекают с участием ферментов дегидрогеназ. Н
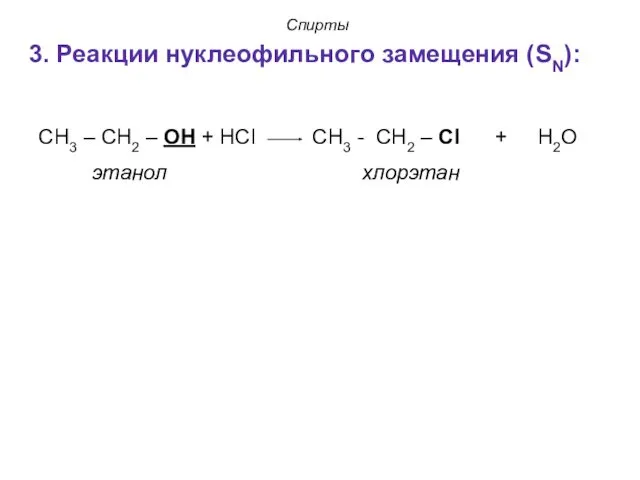
- 22. Спирты 3. Реакции нуклеофильного замещения (SN): СН3 – СН2 – ОН + НCl СН3 - СН2
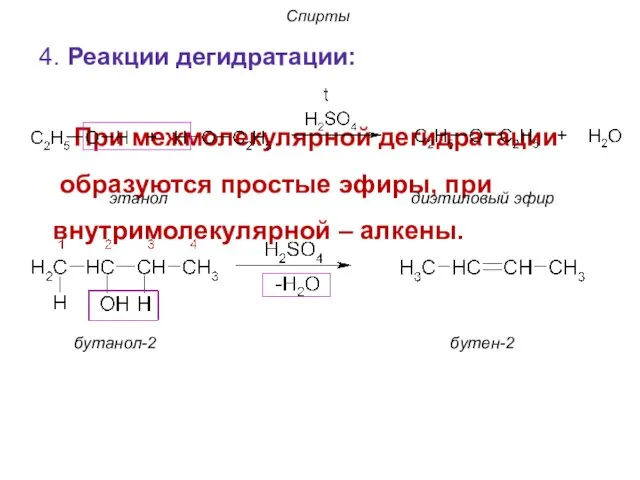
- 23. Спирты 4. Реакции дегидратации: При межмолекулярной дегидратации образуются простые эфиры, при внутримолекулярной – алкены. бутанол-2 бутен-2
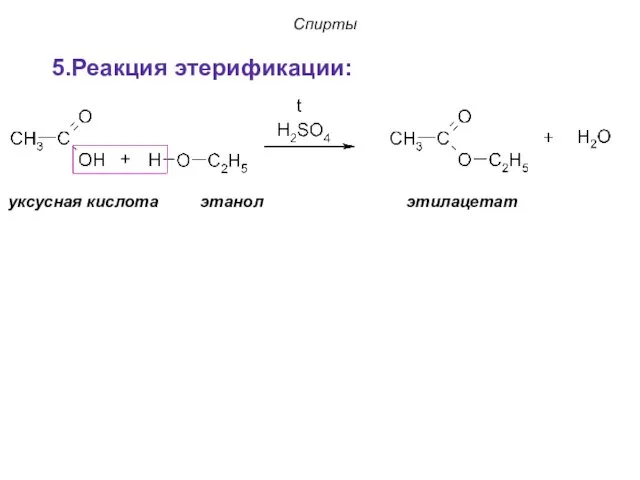
- 24. Спирты уксусная кислота этанол этилацетат 5.Реакция этерификации:
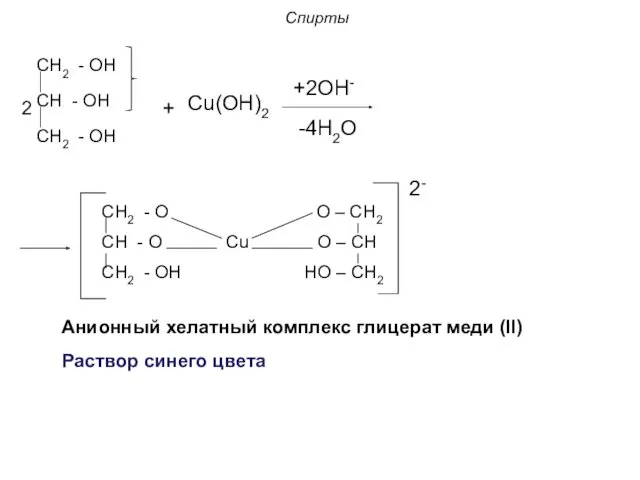
- 25. Спирты 6. Реакция хелатообразования: Многоатомные спирты, проявляя более выраженные кислотные свойства по сравнению с одноатомными спиртами
- 26. Спирты CH2 - OH CH - OH CH2 - OH Cu(ОН)2 +2ОН- -4Н2О CH2 - O
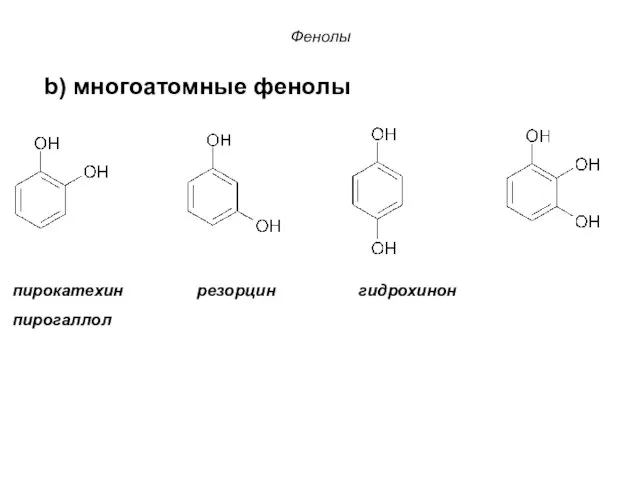
- 27. Фенолы По количеству OH-групп различают: фенол a) Одноатомные фенолы Фенолы – гидроксисоединения, в молекулах которых OH-группы
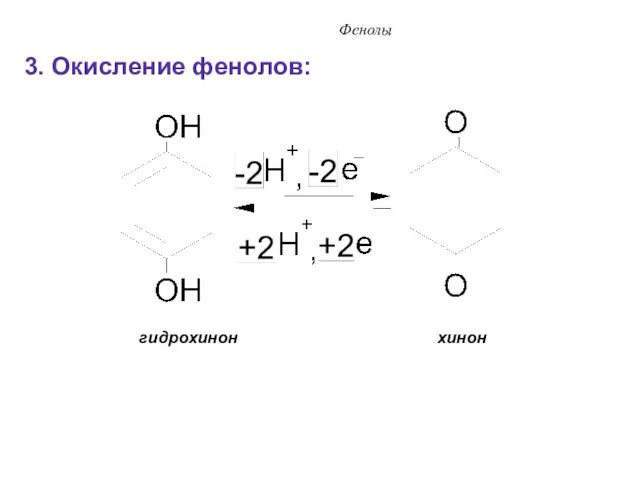
- 28. Фенолы пирокатехин резорцин гидрохинон пирогаллол b) многоатомные фенолы
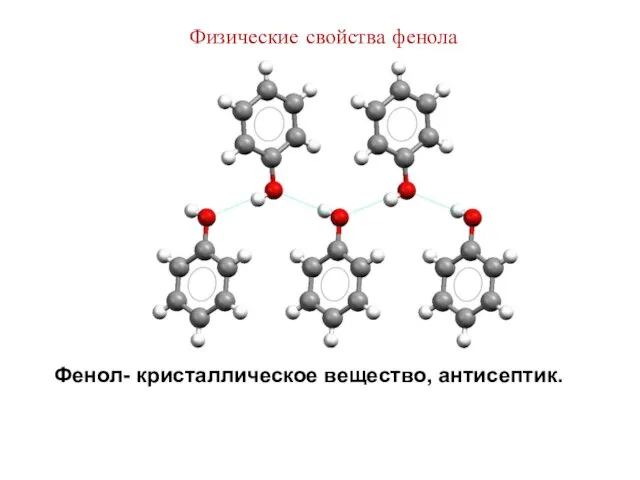
- 29. Физические свойства фенола Фенол- кристаллическое вещество, антисептик.
- 30. Фенол - сильное дезинфицирующее средство; применяется для обезвреживания ран, в процессе лечения воспалительных заболеваний полости рта,
- 31. Применение фенолов в стоматологии Препараты на основе пара-хлофенола
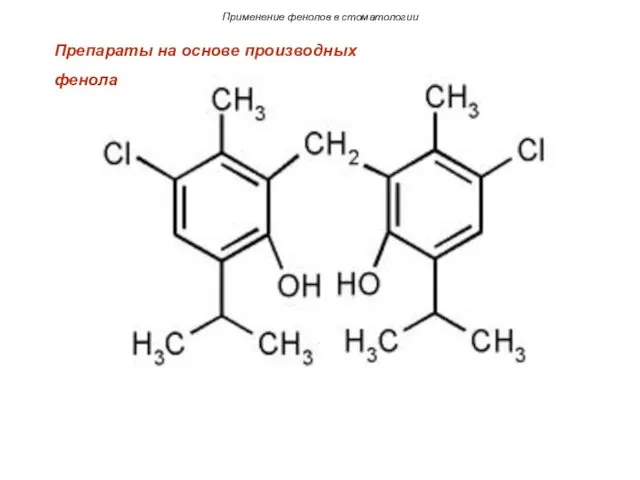
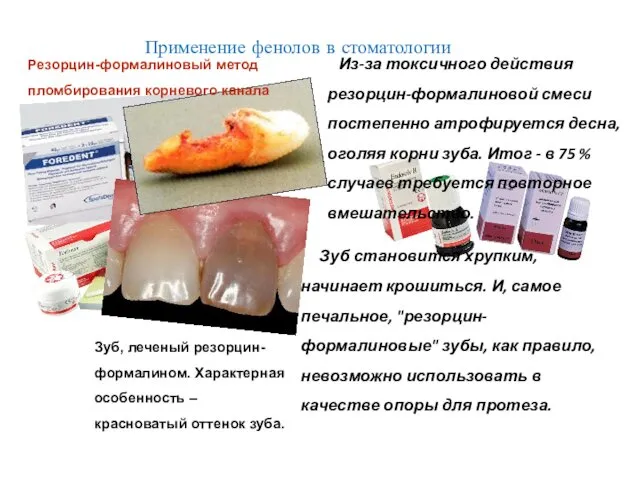
- 32. Применение фенолов в стоматологии Препараты на основе производных фенола
- 33. Зуб, леченый резорцин-формалином. Характерная особенность – красноватый оттенок зуба. Зуб становится хрупким, начинает крошиться. И, самое
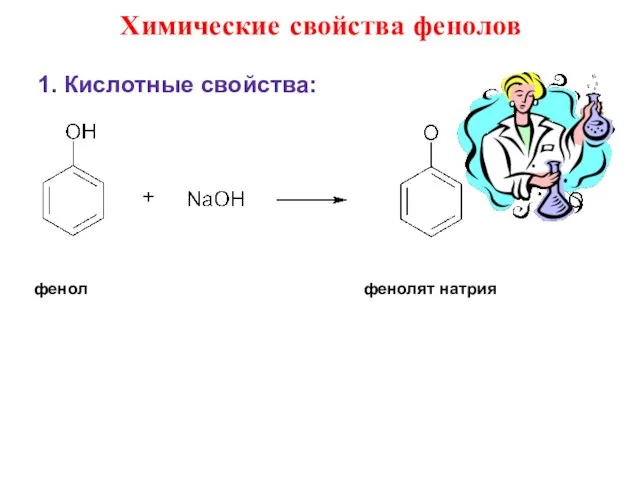
- 34. Химические свойства фенолов 1. Кислотные свойства: фенол фенолят натрия
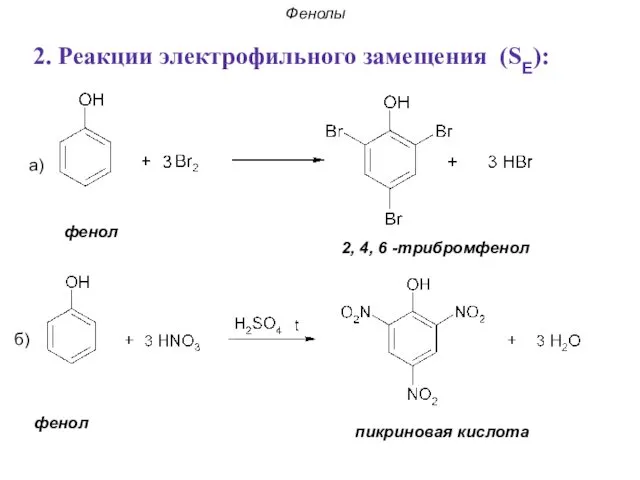
- 35. Фенолы 2. Реакции электрофильного замещения (SE): а) б) фенол пикриновая кислота фенол 2, 4, 6 -трибромфенол
- 36. Фенолы 3. Окисление фенолов: гидрохинон хинон
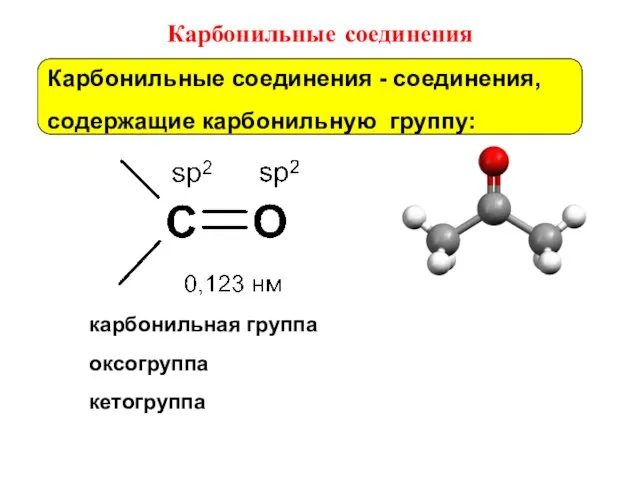
- 37. Карбонильные соединения карбонильная группа оксогруппа кетогруппа Карбонильные соединения - соединения, содержащие карбонильную группу:
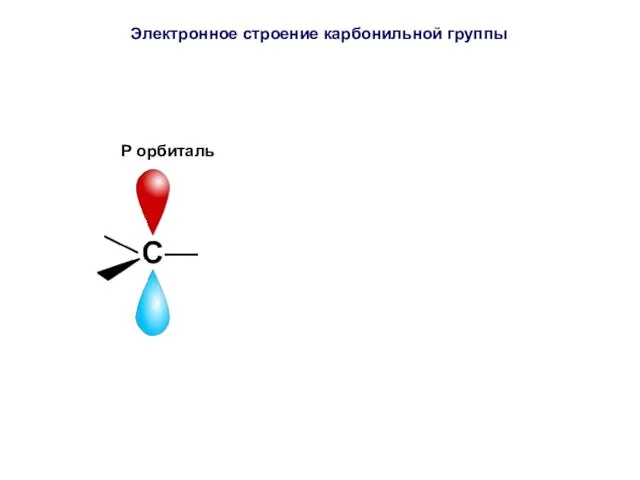
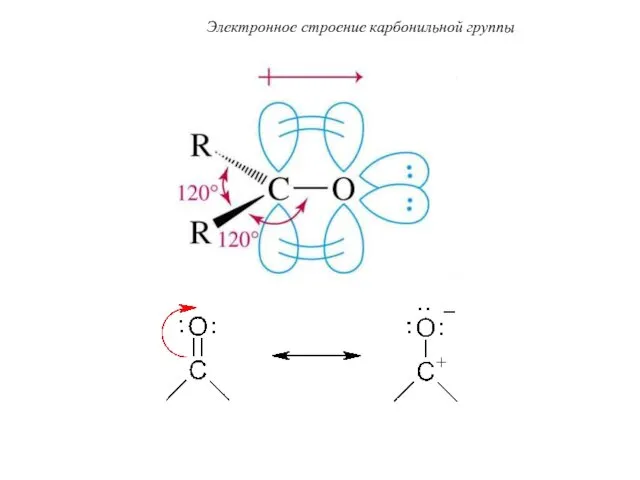
- 38. Электронное строение карбонильной группы Атом углерода находится в состоянии sp -гибридизации. Гибридные орбитали располагаются в одной
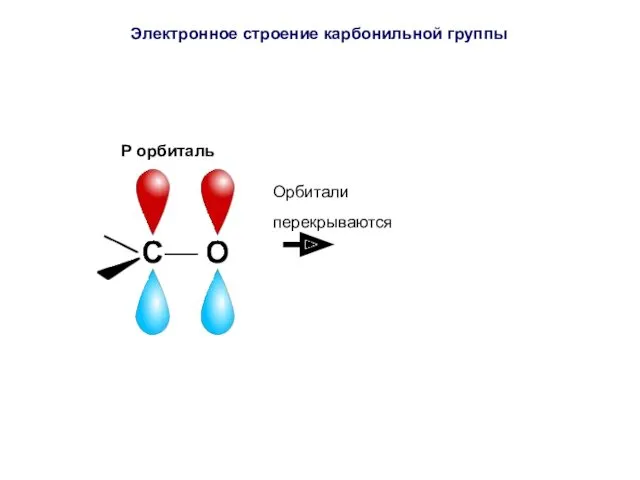
- 39. P орбиталь Электронное строение карбонильной группы
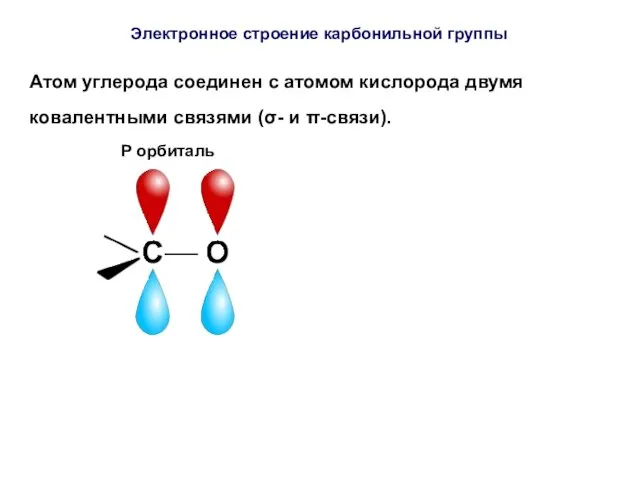
- 40. Атом углерода соединен с атомом кислорода двумя ковалентными связями (σ- и π-связи). P орбиталь Электронное строение
- 41. P орбиталь Орбитали перекрываются Электронное строение карбонильной группы
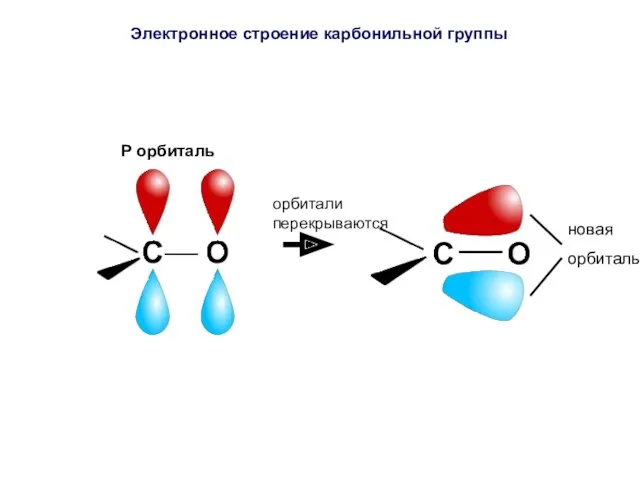
- 42. P орбиталь орбитали перекрываются новая орбиталь Электронное строение карбонильной группы
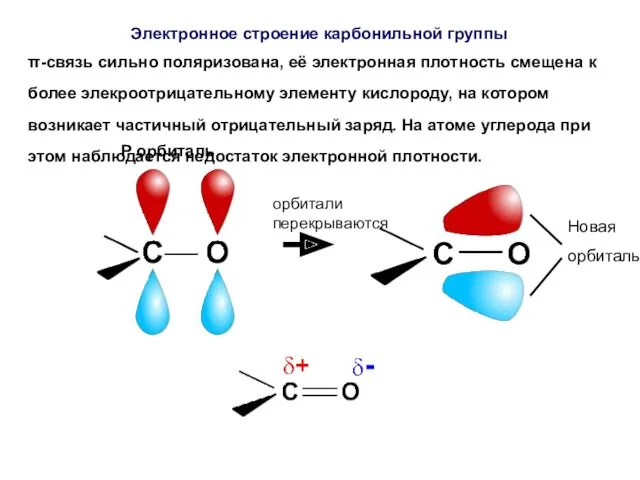
- 43. π-связь сильно поляризована, её электронная плотность смещена к более элекроотрицательному элементу кислороду, на котором возникает частичный
- 44. Электронное строение карбонильной группы
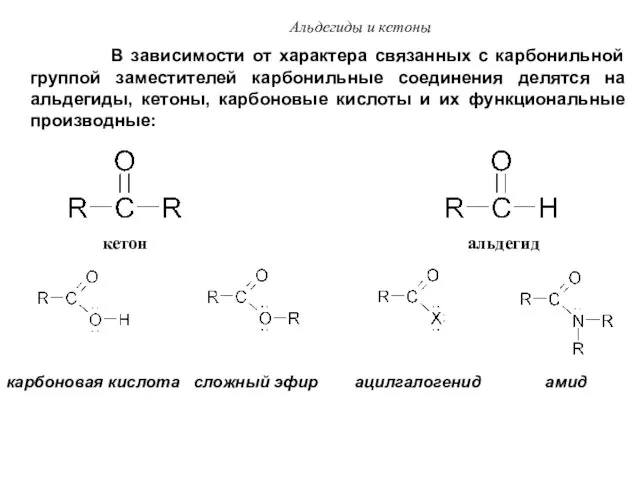
- 45. Альдегиды и кетоны В зависимости от характера связанных с карбонильной группой заместителей карбонильные соединения делятся на
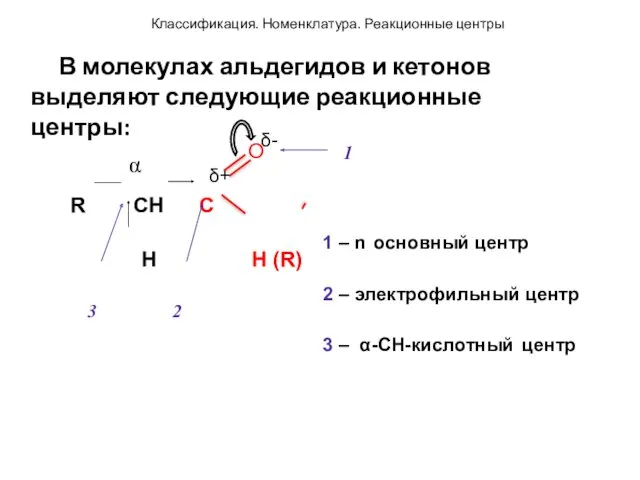
- 46. O 1 R CH C H H (R) 3 2 1 – n основный центр 2
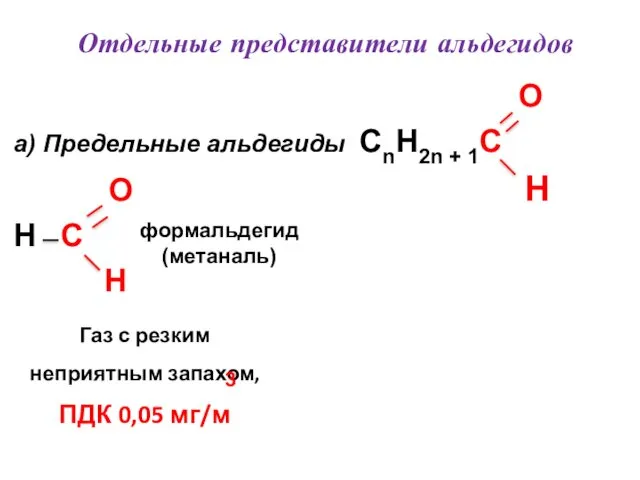
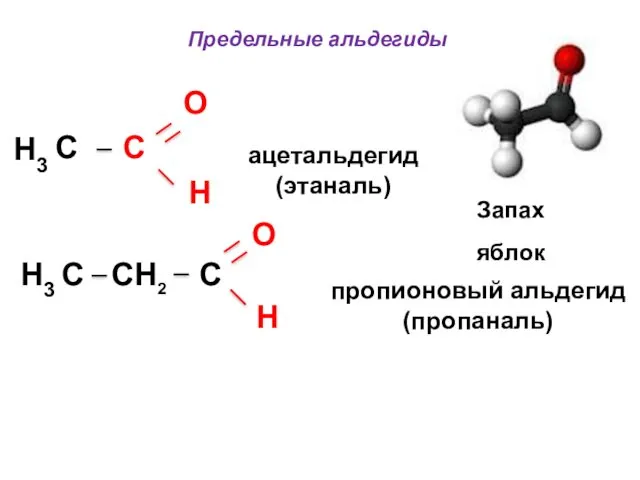
- 47. Отдельные представители альдегидов O a) Предельные альдегиды CnH2n + 1C O H H C H формальдегид
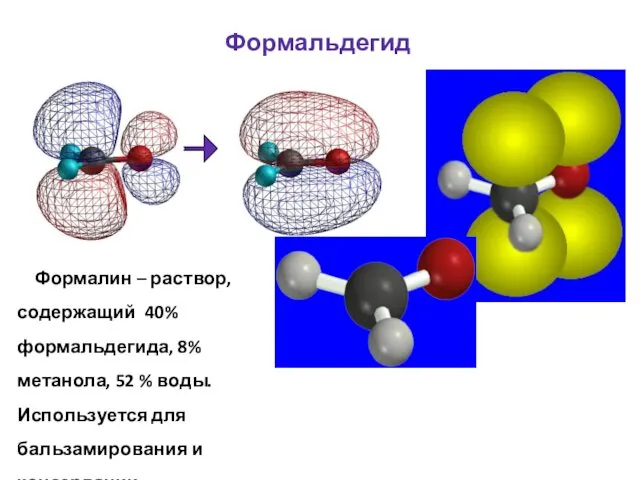
- 48. Формальдегид Формалин – раствор, содержащий 40% формальдегида, 8% метанола, 52 % воды. Используется для бальзамирования и
- 49. Предельные альдегиды O C C H ацетальдегид (этаналь) пропионовый альдегид (пропаналь) H3 H3 C CH2 C
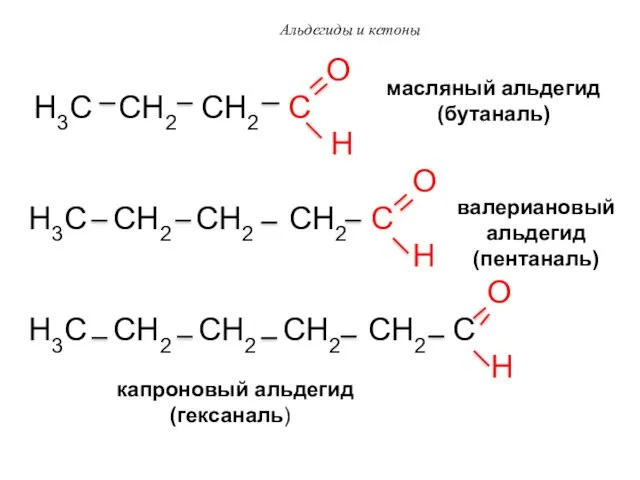
- 50. Альдегиды и кетоны O H3C CH2 CH2 C H O H3C CH2 CH2 CH2 C H
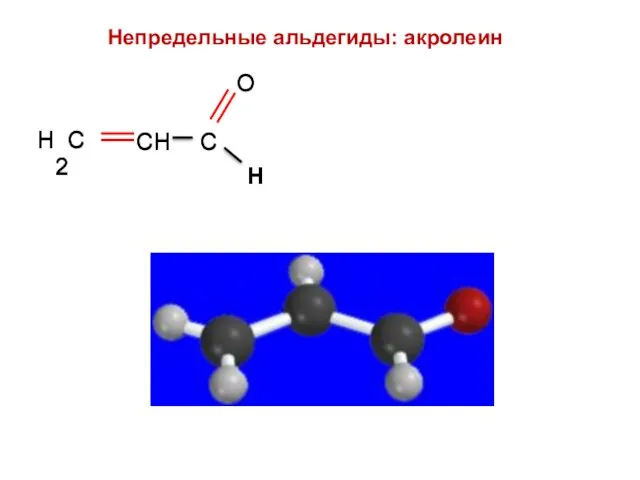
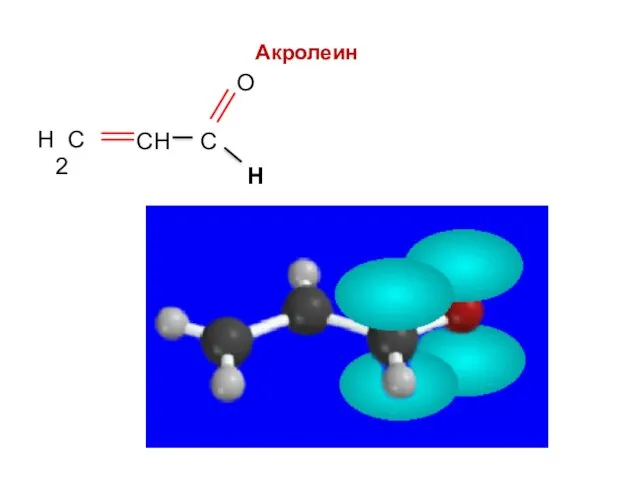
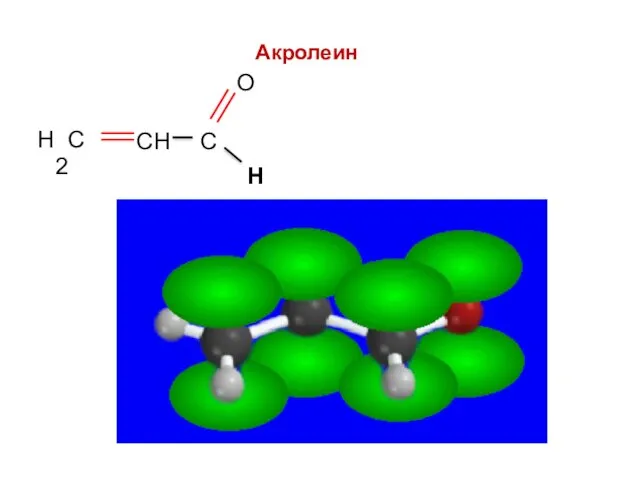
- 51. Н Непредельные альдегиды: акролеин Н
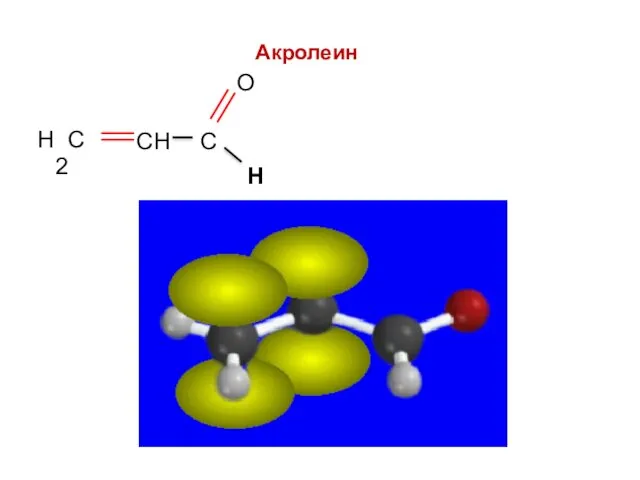
- 52. Акролеин Н
- 53. Акролеин Н
- 54. Акролеин Н
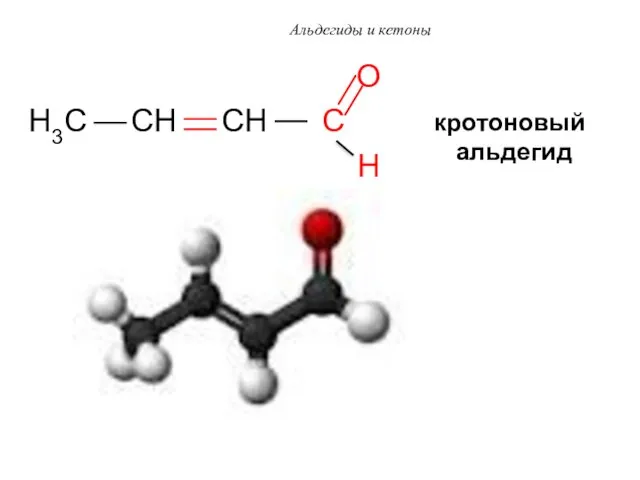
- 55. Альдегиды и кетоны O H3C CH CH C H кротоновый альдегид
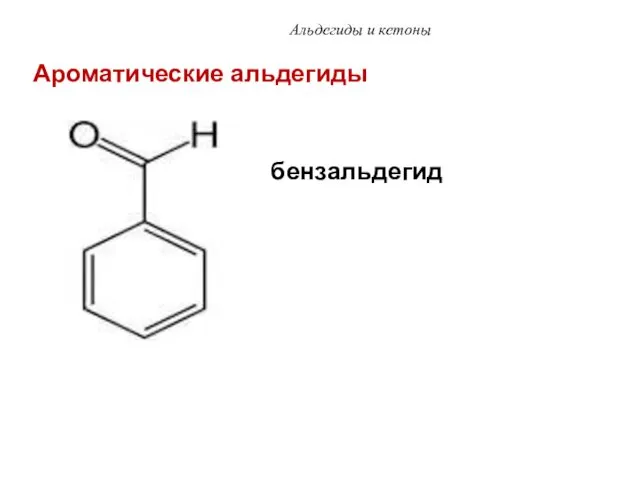
- 56. Альдегиды и кетоны бензальдегид Ароматические альдегиды
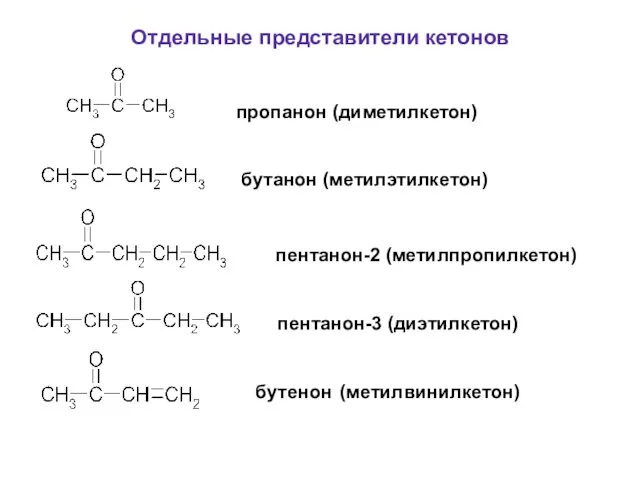
- 57. Отдельные представители кетонов пропанон (диметилкетон) бутанон (метилэтилкетон) пентанон-2 (метилпропилкетон) пентанон-3 (диэтилкетон) бутенон (метилвинилкетон)
- 58. Физические свойства альдегидов и кетонов Низшие альдегиды – газы с резким запахом. Низшие кетоны являются подвижными
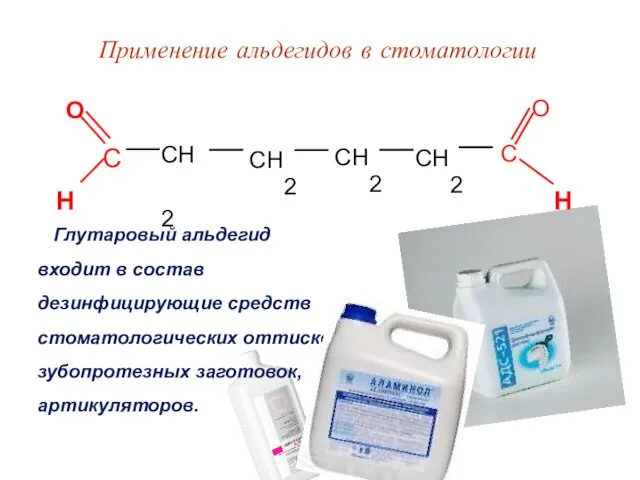
- 59. Применение альдегидов в стоматологии Глутаровый альдегид входит в состав дезинфицирующие средств стоматологических оттисков, зубопротезных заготовок, артикуляторов.
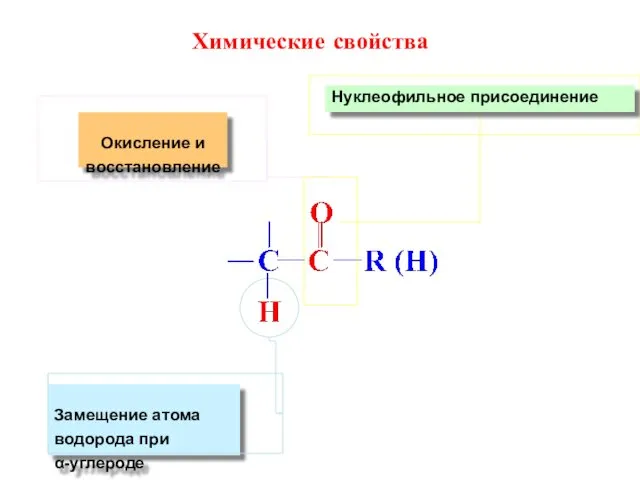
- 60. Нуклеофильное присоединение Окисление и восстановление Замещение атома водорода при α-углероде Химические свойства
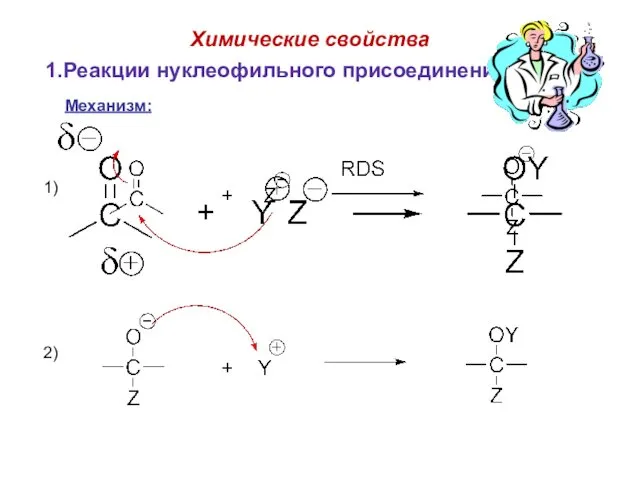
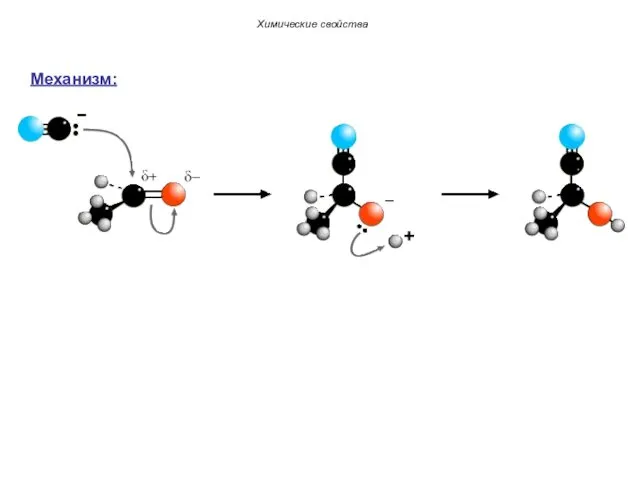
- 61. Химические свойства 1.Реакции нуклеофильного присоединения (AN). Механизм: 1) 2)
- 62. Химические свойства Механизм:
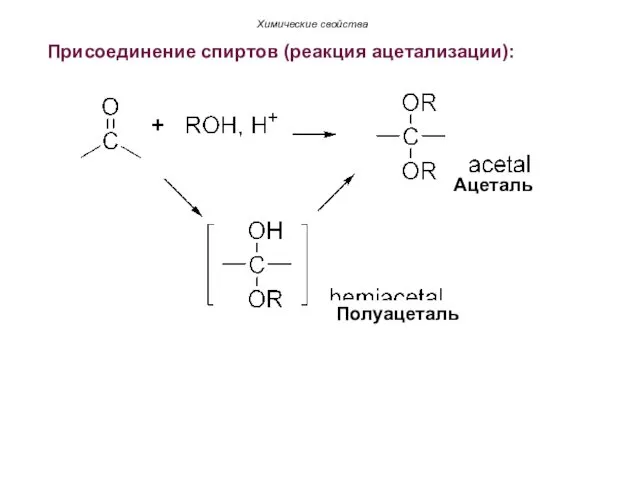
- 63. Присоединение спиртов (реакция ацетализации): Химические свойства Ацеталь Полуацеталь
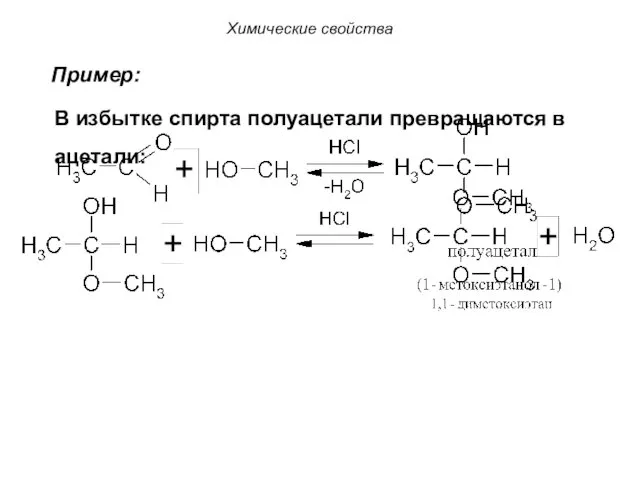
- 64. Химические свойства Пример: В избытке спирта полуацетали превращаются в ацетали:
- 65. Альдегиды и кетоны 2. Окисление альдегидов: O а) H3C C + 2 Cu(OH)2 H O H3C
- 66. Альдегиды и кетоны ацетальдегид уксусная кислота б) Реакция «серебряного зеркала»:
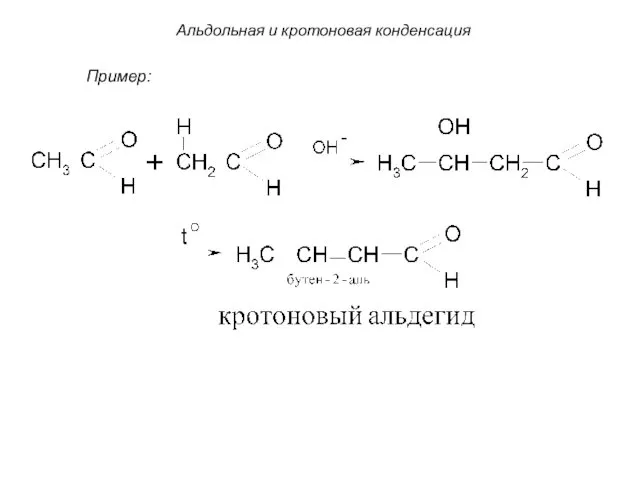
- 67. Общая схема альдольной конденсации: 3. Альдольная и кротоновая конденсация Под влиянием основных катализаторов альдегиды реагируют с
- 68. Альдольная и кротоновая конденсация Пример:
- 69. Шарль-Адольф Вюрц (1817 – 1884) Александр Порфирьевич Бородин (1833 —1887) Альдольная конденсация была открыта практически одновременно
- 70. А. П. Бородин. Портрет работы Ильи Репина (1888) А.П. Бородин открыл реакцию Бородина-Хунсдикера, впервые получил фторорганическое
- 72. Скачать презентацию

















 Основные инфекционные заболевания, их классификация и профилактика
Основные инфекционные заболевания, их классификация и профилактика Мои любимые виды спорта Фигурное катание
Мои любимые виды спорта Фигурное катание Театр будущего и будущее театра
Театр будущего и будущее театра Базовые машины спасательной техники
Базовые машины спасательной техники Texas
Texas Енергозбереження у навчальному закладі та вдома
Енергозбереження у навчальному закладі та вдома Международные стандарты по уплате таможенных платежей В ЕАЭС. (Лекция 6)
Международные стандарты по уплате таможенных платежей В ЕАЭС. (Лекция 6) Мои работы
Мои работы Исследование и разработка алгоритмов и методик обеспечения мобильной безопасности
Исследование и разработка алгоритмов и методик обеспечения мобильной безопасности Атеросклероз коронарной артерии (атероматозная бляшка)
Атеросклероз коронарной артерии (атероматозная бляшка) Методы и средства регистрации ионизирующих излучений. Электретные детекторы
Методы и средства регистрации ионизирующих излучений. Электретные детекторы Геосферы планеты Земля и проблемы устойчивого развития
Геосферы планеты Земля и проблемы устойчивого развития Несоответствие по геометрии. Недолив
Несоответствие по геометрии. Недолив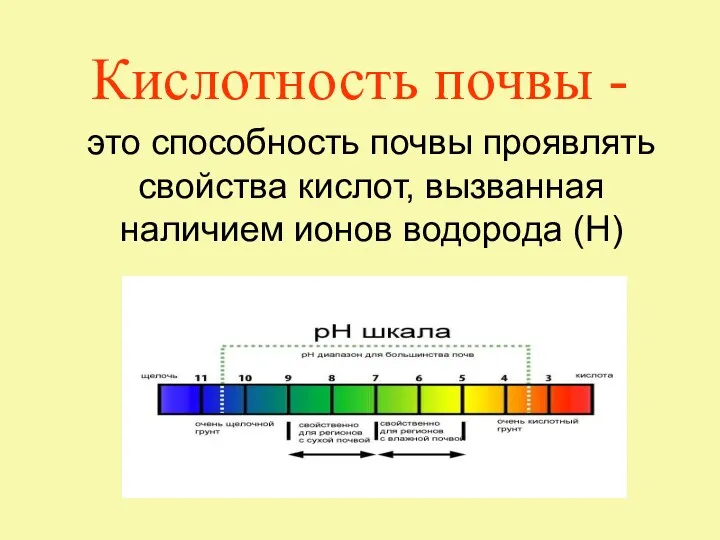 Интегрированный урок по химии и географии Почва 8 класс
Интегрированный урок по химии и географии Почва 8 класс И. С. Тургенев и его произведение Бежин луг
И. С. Тургенев и его произведение Бежин луг Обобщение опыта Применение ИКТ технологий на уроках математики
Обобщение опыта Применение ИКТ технологий на уроках математики Радиоактивность как свидетельство сложного строения атомов
Радиоактивность как свидетельство сложного строения атомов Презентация к открытому уроку по ПМ 02 Участие в лечебно-диагностическом и реабилитационном процессах МДК 02.01 Сестринская помощь при нарушениях здоровья. Инфекционные болезни с курсом ВИЧ-инфекции и эпидемиологии Тема &quot
Презентация к открытому уроку по ПМ 02 Участие в лечебно-диагностическом и реабилитационном процессах МДК 02.01 Сестринская помощь при нарушениях здоровья. Инфекционные болезни с курсом ВИЧ-инфекции и эпидемиологии Тема &quot Географические исследования на территории Казахстана
Географические исследования на территории Казахстана Климат и человек (презентация 8 класс)
Климат и человек (презентация 8 класс) Мозаика из бумаги
Мозаика из бумаги Растениеводство. Зерновые культуры
Растениеводство. Зерновые культуры Заповедники Воронежской области
Заповедники Воронежской области Конспект занятия математического кружка Старинные задачи на дроби
Конспект занятия математического кружка Старинные задачи на дроби Смешарики. Автоматизация звука р
Смешарики. Автоматизация звука р Презентация к уроку Военно-революционные потрясения на Обь-Иртышском Севере
Презентация к уроку Военно-революционные потрясения на Обь-Иртышском Севере Голубая роза – объединение художников, существовавшее в начале XX века
Голубая роза – объединение художников, существовавшее в начале XX века России милый уголок (презентация)
России милый уголок (презентация)