Содержание
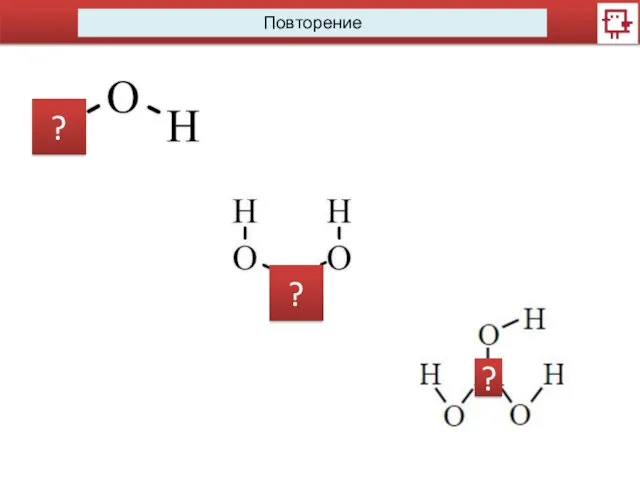
- 2. Повторение ? ? ?
- 3. Повторение CaO + H2O ? CuCl2 + NaOH ? Li2O + H2O ? CaCO3 + SiO2
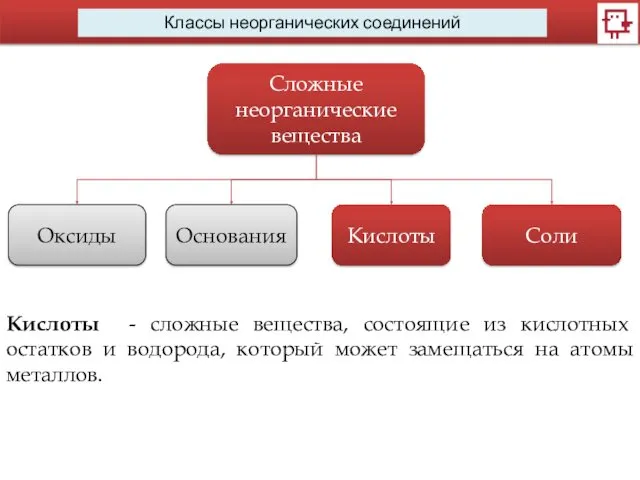
- 4. Классы неорганических соединений Сложные неорганические вещества Оксиды Основания Кислоты Соли Кислоты - сложные вещества, состоящие из
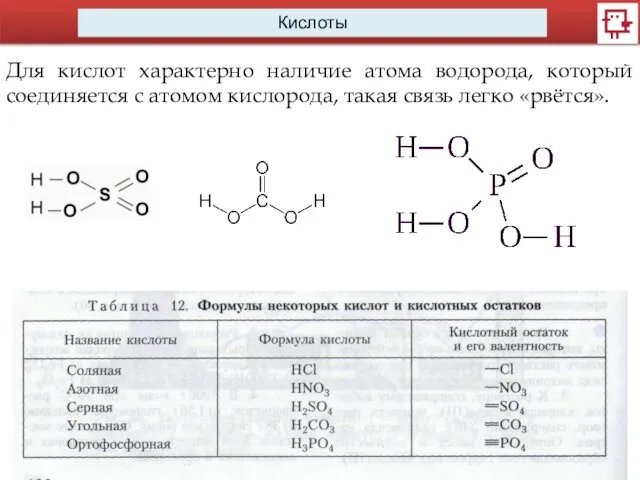
- 5. Кислоты Для кислот характерно наличие атома водорода, который соединяется с атомом кислорода, такая связь легко «рвётся».
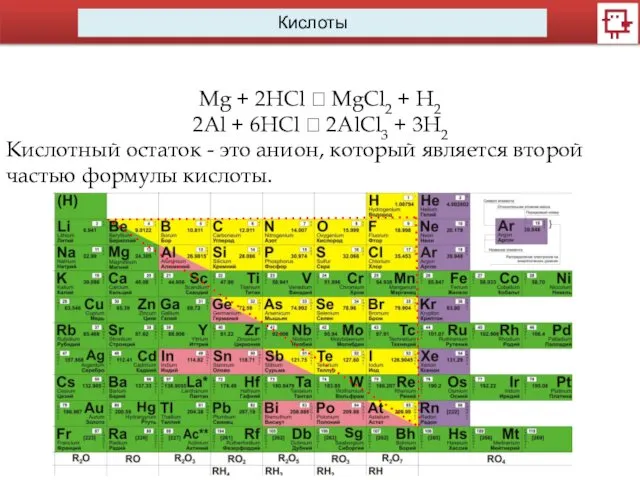
- 6. Кислоты Mg + 2HCl ? MgCl2 + H2 2Al + 6HCl ? 2AlCl3 + 3H2 Кислотный
- 7. Кислоты Mg + 2HCl ? MgCl2 + H2 2Al + 6HCl ? 2AlCl3 + 3H2 Кислотные
- 8. Кислоты Физические свойства. Многие кислоты – жидкости: серная, азотная и т.д. Некоторые твёрдые: кремниевая H2SiO3, ортофосфорная
- 9. Кислоты Физические свойства. Многие кислоты – жидкости: серная, азотная и т.д. Некоторые твёрдые: кремниевая H2SiO3, ортофосфорная
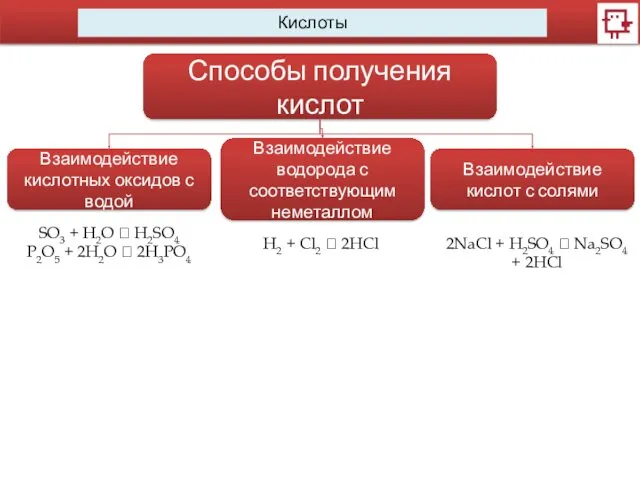
- 10. Кислоты Способы получения кислот Взаимодействие кислотных оксидов с водой Взаимодействие водорода с соответствующим неметаллом Взаимодействие кислот
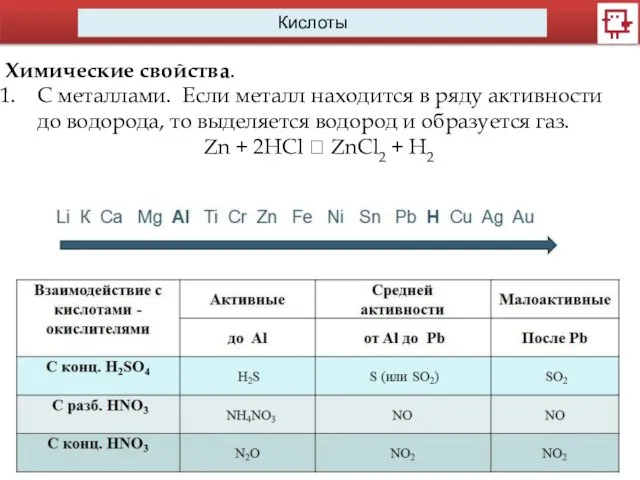
- 11. Кислоты Химические свойства. C металлами. Если металл находится в ряду активности до водорода, то выделяется водород
- 12. Кислоты Химические свойства. 2. C основными оксидами. Образуется соль и вода. CuO + H2SO4 ? CuSO4
- 13. Кислоты Химические свойства. 3. С основаниями. Образуется соль и вода. NaOH + HCl ? NaCl +
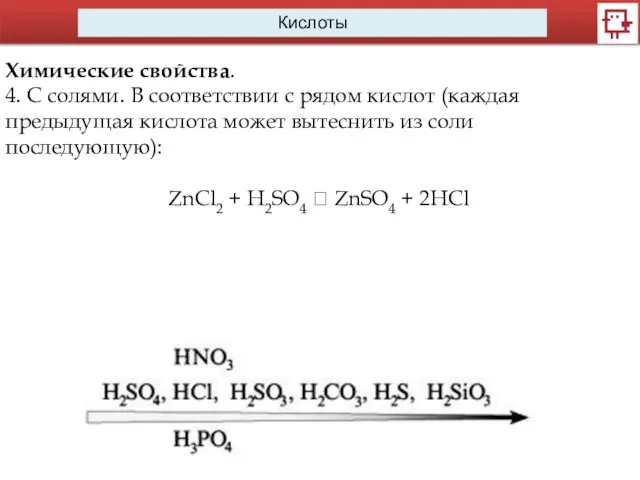
- 14. Кислоты Химические свойства. 4. С солями. В соответствии с рядом кислот (каждая предыдущая кислота может вытеснить
- 16. Скачать презентацию






 Эпидемиологическое обоснование выбора методов, средств и режимов их применения для очистки, ДВУ и стерилизации эндоскопов
Эпидемиологическое обоснование выбора методов, средств и режимов их применения для очистки, ДВУ и стерилизации эндоскопов Решение задач по теме Треугольник
Решение задач по теме Треугольник Стихи о дорожных знаках.
Стихи о дорожных знаках. Рентгеноанатомия глотки и пищевода
Рентгеноанатомия глотки и пищевода Пізня зрілість (Е. Еріксон)
Пізня зрілість (Е. Еріксон) Здоровое питание
Здоровое питание Углерод
Углерод Антикризове управління в АПК
Антикризове управління в АПК My life
My life Проектирование реакционного узла для жидкофазных реакторов. Лекция 5
Проектирование реакционного узла для жидкофазных реакторов. Лекция 5 Империя Наполеона. Урок 9
Империя Наполеона. Урок 9 Николай Михайлович Рубцов
Николай Михайлович Рубцов Продукция в нефтегазовой промышленности
Продукция в нефтегазовой промышленности Мой край-Подгоренский
Мой край-Подгоренский Презентация Олимпийские игры 2012
Презентация Олимпийские игры 2012 Презентация к уроку по товароведению Качество продовольственных товаров
Презентация к уроку по товароведению Качество продовольственных товаров Бумажная пластика. Ажурные снежинки
Бумажная пластика. Ажурные снежинки Олимпийские игры
Олимпийские игры Психологические аспекты межэтнического взаимодействия
Психологические аспекты межэтнического взаимодействия Основы проектного управления. Эффективная работа команды
Основы проектного управления. Эффективная работа команды Общественное производство и экономческие отношения
Общественное производство и экономческие отношения Сочинение по картине И.И.Левитана Весна. Большая вода
Сочинение по картине И.И.Левитана Весна. Большая вода Презентация Весёлые вытворяшки Диск
Презентация Весёлые вытворяшки Диск С новым Годом, друзья!
С новым Годом, друзья! Урок химии в 10 кл.Генетическая связь УВ и кислородсодержащих орг. соединений
Урок химии в 10 кл.Генетическая связь УВ и кислородсодержащих орг. соединений Машины для мелиоративных работ
Машины для мелиоративных работ Замкнутый ресурсный цикл твердых бытовых отходов
Замкнутый ресурсный цикл твердых бытовых отходов Avon. Секреты успешных онлайн-продаж
Avon. Секреты успешных онлайн-продаж