Содержание
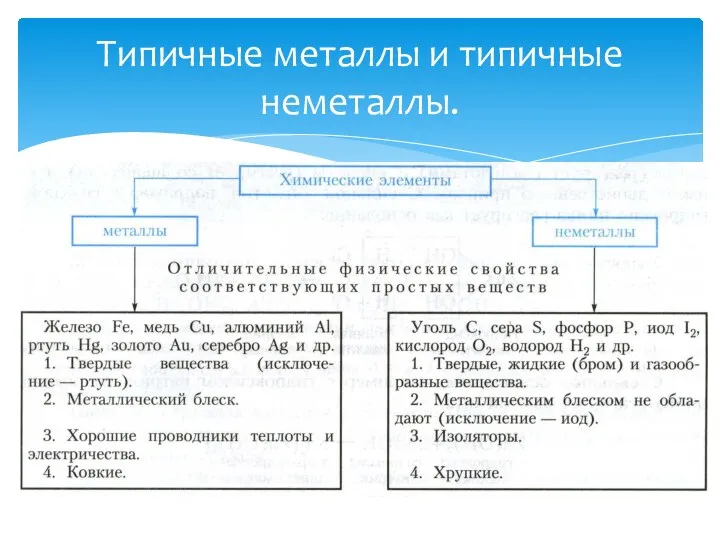
- 3. Типичные металлы и типичные неметаллы.
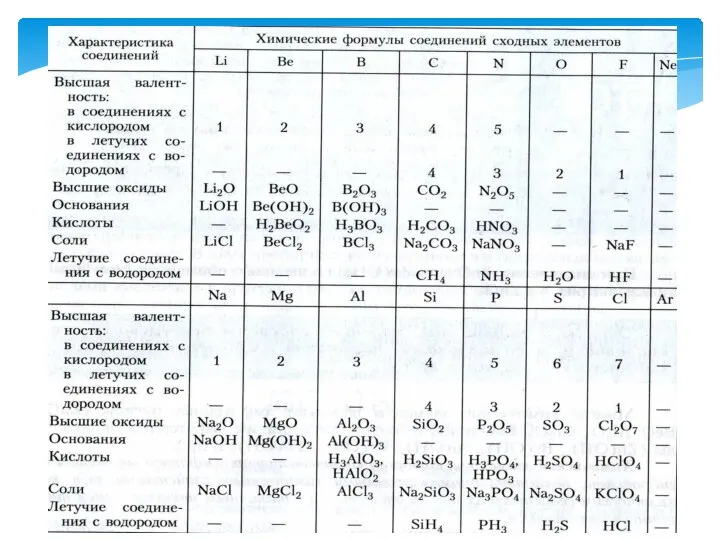
- 4. Типичный металл взаимодействует с кислородом и образует основный оксид: Na2O, MgO, CaO, BaO, K2O. 2Ca +
- 5. Найди соответствие, для этого выбери каждому номеру букву верного утверждения: 1.Ртуть А. Твердое вещество 2.сера Б.
- 6. 1- Б, В, Ж. 2 – А, Д. 3 – А, Б, Г, Ж. 4 -
- 7. Есть элементы, которые образуют оксиды и гидроксиды, проявляющие амфотерные свойства. Амфотерными называют оксиды и гидроксиды, которые
- 8. Оксид цинка взаимодействует с кислотами образуя соль и воду: ZnO + H2SO4 = ZnSO4, следовательно, оксид
- 9. Оксид и гидроксид цинка взаимодействуют с сильными щелочами и образуют соль и воду: ZnO + 2NaOH
- 10. Составьте уравнения реакций, доказывающих амфотерный характер оксида и гидроксида алюминия Al2O3 + 6HNO3 =2 Al(NO3)3 +
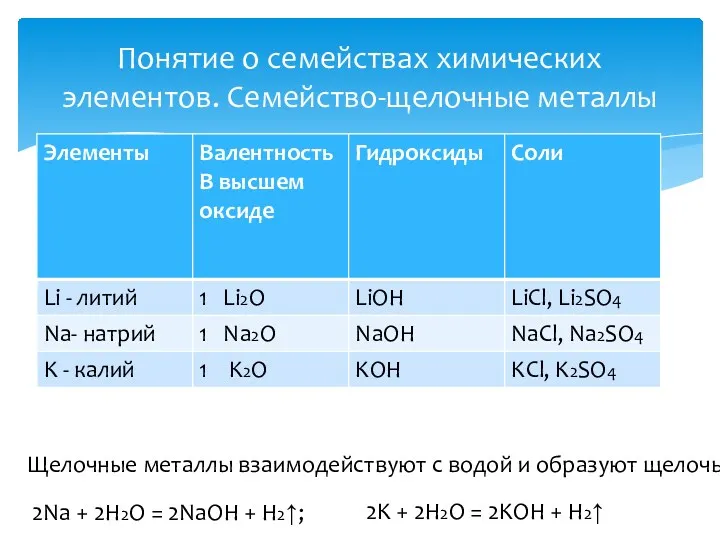
- 11. Понятие о семействах химических элементов. Семейство-щелочные металлы Щелочные металлы взаимодействуют с водой и образуют щелочь 2Na
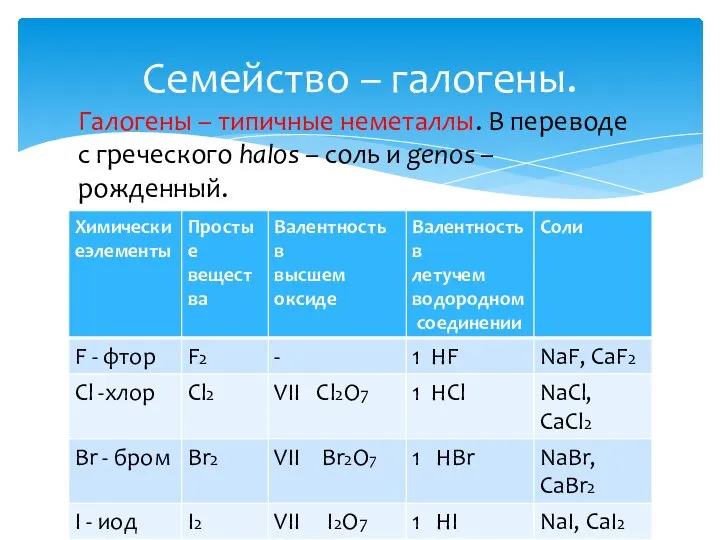
- 12. Семейство – галогены. Галогены – типичные неметаллы. В переводе с греческого halos – соль и genos
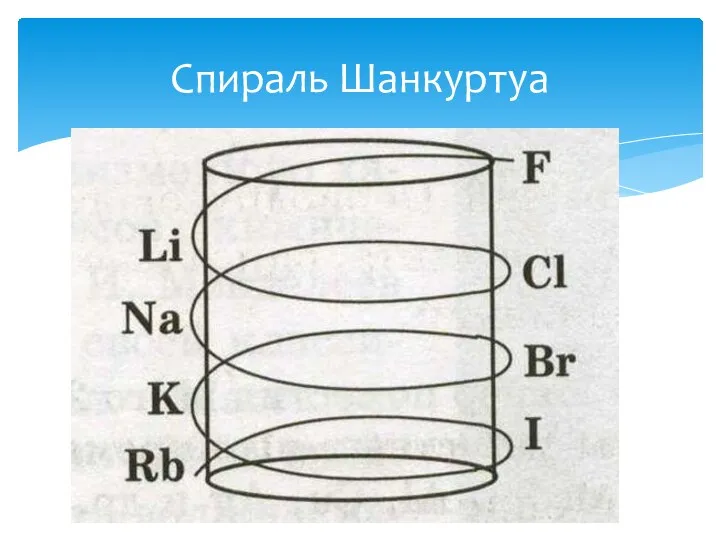
- 13. Многие химики: немецкие ученые И. Деберейнер и Л. Мейер, англичанин Дж. Ньюлендс, француз А. Шанкуртуа и
- 14. Спираль Шанкуртуа
- 15. Закон октав Дж. Ньюлендса
- 16. Триады Дёберейнера Триады Деберейнера (1816 г.). Немецкий химик И. В. Деберейнер разделил элементы по три на
- 17. Таблица химических элементов Л. Мейера
- 21. С возрастанием атомного веса 1)металлические свойства постепенно ослабевают (Na Mg Al Si), а неметаллические усиливаются (Si,
- 22. Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины
- 23. Почему свойства химических элементов, расположенных в порядке возрастания относительных атомных масс, изменяются периодически? Почему в некоторых
- 25. Скачать презентацию

















 Образовательная программа. Инновационные технологии и современное историческое знание
Образовательная программа. Инновационные технологии и современное историческое знание Ораторское искусство
Ораторское искусство Займи активную позицию в создании своего будущего
Займи активную позицию в создании своего будущего Методы повышения нефтеотдачи
Методы повышения нефтеотдачи Железобетонные резервуары
Железобетонные резервуары Разработка программы моделирования канала передачи потоковых данных оптико-электронных средств
Разработка программы моделирования канала передачи потоковых данных оптико-электронных средств Корабли
Корабли Приготовление бетонной смеси
Приготовление бетонной смеси Музыкальные формы
Музыкальные формы Штучний інтелект
Штучний інтелект Внеклассное мероприятие Никто не забыт, ничто не забыто...
Внеклассное мероприятие Никто не забыт, ничто не забыто... Русская народная кукла: обычаи и традиции. Осенние куклы
Русская народная кукла: обычаи и традиции. Осенние куклы Христиан діні туралы
Христиан діні туралы Временный режим работы МАОУ Гимназия г. Троицка в условиях сохранения риска распространения COVID-19 до 01.01.2021 года
Временный режим работы МАОУ Гимназия г. Троицка в условиях сохранения риска распространения COVID-19 до 01.01.2021 года Vorgangspassiv
Vorgangspassiv Дальневосточный морской заповедник
Дальневосточный морской заповедник Биологиялық дозиметрия (электрондық парамагниттік резонанс және тағы басқалары) және олардың тәжірибеде қолданылуы
Биологиялық дозиметрия (электрондық парамагниттік резонанс және тағы басқалары) және олардың тәжірибеде қолданылуы Освоение Сибири
Освоение Сибири Обмен электронными счетамифактурами и другими документами ООО “Комацу СНГ”
Обмен электронными счетамифактурами и другими документами ООО “Комацу СНГ” 10 шагов составления эффективных презентаций Powerpoint
10 шагов составления эффективных презентаций Powerpoint Welcome to Apple
Welcome to Apple Лексические нормы
Лексические нормы Актовий зал
Актовий зал Планирование ремонтно-строительного производства при реконструкции и капитальном ремонте
Планирование ремонтно-строительного производства при реконструкции и капитальном ремонте Организация обслуживания ресторана высшего класса на 120 мест
Организация обслуживания ресторана высшего класса на 120 мест Классификация источников эмиссии биологического фактора по группам риска
Классификация источников эмиссии биологического фактора по группам риска Контрольная работа по теме Четырехугольники
Контрольная работа по теме Четырехугольники Поняття, зміст, правові засади публічної (громадської) безпеки і порядку
Поняття, зміст, правові засади публічної (громадської) безпеки і порядку