Содержание
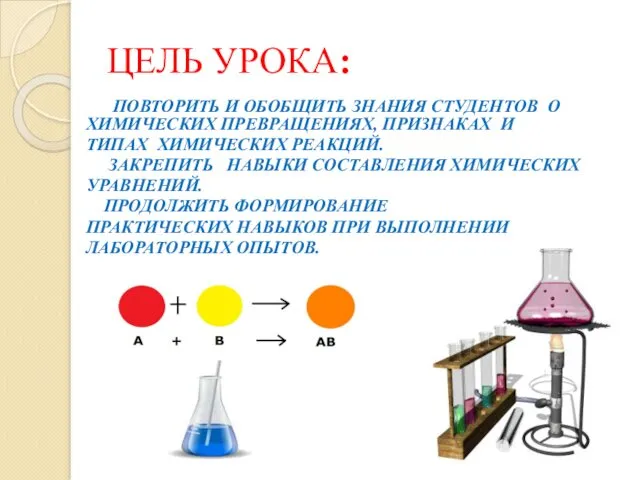
- 2. ЦЕЛЬ УРОКА: ПОВТОРИТЬ И ОБОБЩИТЬ ЗНАНИЯ СТУДЕНТОВ О ХИМИЧЕСКИХ ПРЕВРАЩЕНИЯХ, ПРИЗНАКАХ И ТИПАХ ХИМИЧЕСКИХ РЕАКЦИЙ. ЗАКРЕПИТЬ
- 3. Вопросы для повторения 1.Что изучает химия? 2. Какие классы неорганических веществ вы знаете? 3.Что такое физические
- 4. Вспомним, какие явления называются физическими и химическими. Физические явления -это любые изменения вещества, не при водящие
- 5. Определить, какие процессы относятся к физическим, а какие – к химическим и распределите их по двум
- 8. Признаки химической реакции: выделение тепла и света ГОРЕНИЕ СВЕЧИ
- 9. Реакция между раствором хлорида кальция и раствором щелочи. выпадение осадка.
- 10. Действие индикаторов на растворы кислоты, щелочи и воды. изменение цвета (окраски индикатора).
- 11. РЕАКЦИЯ МЕДИ С АЗОТНОЙ КИСЛОТОЙ выделение газа
- 12. Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ; выделению или поглощению
- 13. Реакция соединения. Fe S + Реакция соединения -это реакция, при которой из двух или нескольких простых
- 14. Реакция разложения Ca S → Реакция разложения - это реакция, при которой одно сложное вещество распадается
- 15. Реакция замещения Fe + H Cl Реакция замещения -это реакция, при которой атомы простого вещества замещают
- 16. Реакция обмена Ag NO3 + H Cl Реакция обмена - это реакция, при которой два сложных
- 17. Выделение или поглощение энергии: Реакции, протекающие с выделением энергии (тепла), называются экзотермическими. К ним относятся реакции
- 18. Окислительно-восстановительные реакции: Реакции, сопровождающиеся изменением степеней окисления элементов, т. е. переходом электронов,называются окислительно-восстановительными: Fe0 + S0
- 19. Выделение или поглощение энергии Экзотермические реакции — это реакции, происходящие с выделением теплоты. СН4(г) + 2О2(г)
- 20. По агрегатному состоянию По фазовому состоянию реагентов реакции бывают гомогенные (однородные) и гетерогенные (неоднородные). В гомогенных
- 21. Соотнесите: А-Г1 ; Б-В1; В-Б1; Г-А1.
- 22. Игра «ТРЕТИЙ ЛИШНИЙ-1» 1. 2NaCl = 2Na + Cl2 2. MgO + CO2 = MgCO3 3.
- 23. Игра «ТРЕТИЙ ЛИШНИЙ-2» 1.2Na + H2O = 2NaOH + H2 2. 2CO + O2 = 2CO2
- 24. Самостоятельная работа Вариант 1 Вариант 2 Задание № 1:расставьте коэффициенты и определите тип реакции в следующих
- 25. Проверка выполненной работы Вариант 1 Вариант 2 a) BaO + 2HCl = BaCl2 +H2O a) Mg(OH)2
- 26. Что вам сегодня понравилось на уроке? Домашнее задание: работа с конспектом Рефлексия. Что вас понравилось сегодня
- 28. Скачать презентацию
























 Орехи и масличные семена в кондитерском производстве
Орехи и масличные семена в кондитерском производстве Страхование детей от несчастного случая
Страхование детей от несчастного случая Умники и умницы
Умники и умницы Управление нефтегазовыми технологическими процессами - 1
Управление нефтегазовыми технологическими процессами - 1 Формирование простых запросов к готовой базе данных. (9 класс)
Формирование простых запросов к готовой базе данных. (9 класс) Городецкая роспись
Городецкая роспись Соотношение цивилизации и культуры в рассказе Р
Соотношение цивилизации и культуры в рассказе Р a (2)
a (2) Экономическое развитие России в начале XX века
Экономическое развитие России в начале XX века 4-е заседание РМО по профориентации
4-е заседание РМО по профориентации Архитектура ЭВМ
Архитектура ЭВМ Врождённые ортопедические заболевания. Мышечная кривошея, косолапость. Врождённый вывих бедра. Несовершенный остеогенез
Врождённые ортопедические заболевания. Мышечная кривошея, косолапость. Врождённый вывих бедра. Несовершенный остеогенез ВИЧ-инфекция
ВИЧ-инфекция Образ дома в современной русской литературе (на материале пьесы Л. С. Петрушевской Три девушки в голубом)
Образ дома в современной русской литературе (на материале пьесы Л. С. Петрушевской Три девушки в голубом) Іштің тік бұлшықетінің қынабы. Іштің ақ сызығы. Кіндік сақинасы. Шап өзегі
Іштің тік бұлшықетінің қынабы. Іштің ақ сызығы. Кіндік сақинасы. Шап өзегі Невынашивание беременности. Преждевременные роды. Лечение. Профилактика
Невынашивание беременности. Преждевременные роды. Лечение. Профилактика Школьное объединение детей и подростков РИТМ (романтики, искатели, творители, мечтатели)
Школьное объединение детей и подростков РИТМ (романтики, искатели, творители, мечтатели) Презентация Мы за ЗОЖ_Экспедиция выходного дня_ Дедова Н.В._ ДХС Искра
Презентация Мы за ЗОЖ_Экспедиция выходного дня_ Дедова Н.В._ ДХС Искра Міжнародні фінансово-кредитні установи та їх співробітництво з Україною. (Тема 16)
Міжнародні фінансово-кредитні установи та їх співробітництво з Україною. (Тема 16) Игра Угадай мелодию
Игра Угадай мелодию Делители и кратные
Делители и кратные Уголовное судопроизводство
Уголовное судопроизводство Презентация инновационного опыта
Презентация инновационного опыта Лошадь в мифах и легендах
Лошадь в мифах и легендах Презентация к классному часу на тему Цветы
Презентация к классному часу на тему Цветы Обыкновенные дроби. Доли
Обыкновенные дроби. Доли картотека загадок по лексической теме Домашние животные
картотека загадок по лексической теме Домашние животные Праздники ислама
Праздники ислама