Содержание
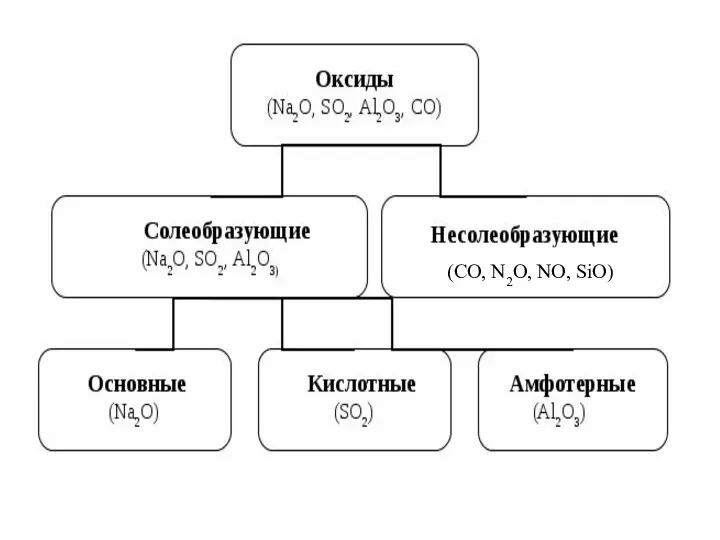
- 2. Оксиды-это сложные вещества, которые состоят из двух элементов, одним из которых является кислород. Общая формула оксидов:
- 3. ( (CO, N2O, NO, SiO)
- 4. Типичные реакции кислотных оксидов 1. Кислотный оксид + щёлочь→соль + вода (реакция обмена). SO3+2KOH→K2SO4+H2O CO2+Ca(OH)2→CaCO3+H2O 2.
- 5. Кислоты, соответствующие оксидам CO2 ? H2CO3 SiO2 ? H2SiO3 P2O5 ? H3PO4 N2O3 ? HNO2 N2O5
- 6. Типичные реакции основных оксидов 3. Основный оксид + кислота→соль + вода (реакция обмена) CuO + H2SO4→CuSO4
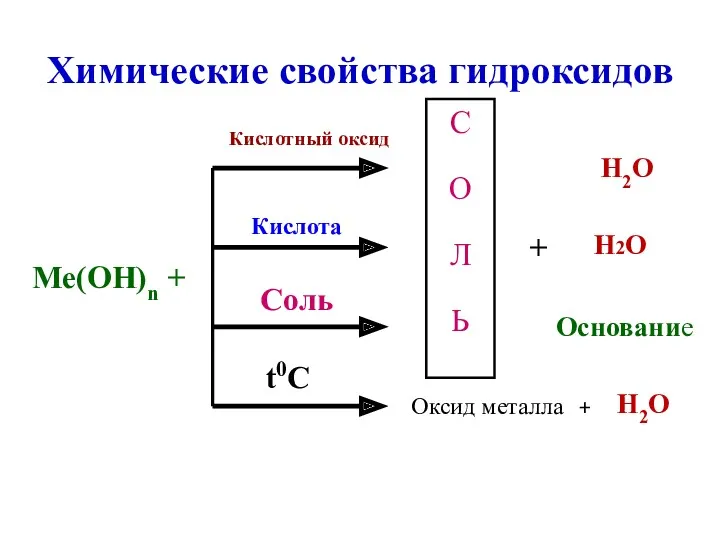
- 7. Химические свойства гидроксидов Me(OH)n + С О Л Ь Кислотный оксид Кислота Соль + Н2О Н2О
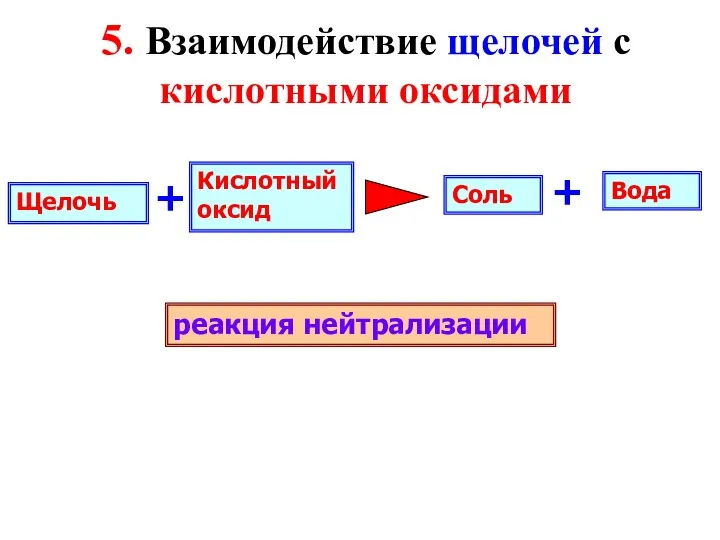
- 8. Щелочь Кислотный оксид + Вода Соль + реакция нейтрализации 5. Взаимодействие щелочей с кислотными оксидами
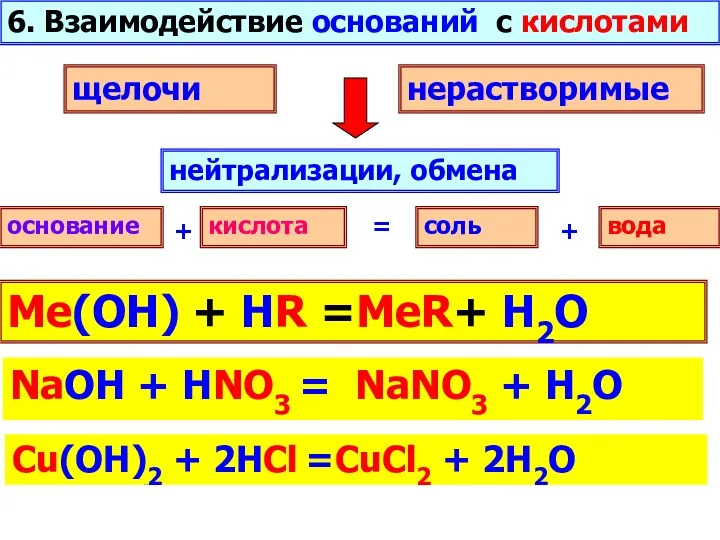
- 9. 6. Взаимодействие оснований с кислотами нейтрализации, обмена щелочи нерастворимые основание соль кислота вода + + =
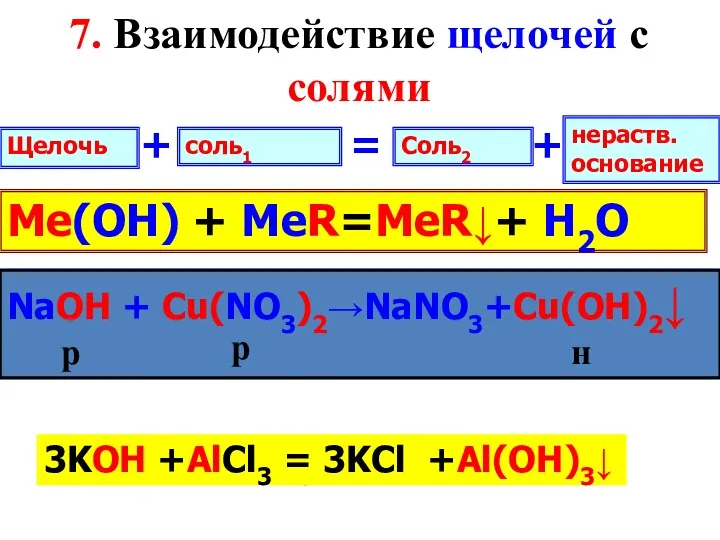
- 10. NaOH + Сu(NO3)2→ NaOH + Сu(NO3)2→NaNO3+Cu(OH)2↓ Щелочь соль1 + нераств. основание Соль2 + 7. Взаимодействие щелочей
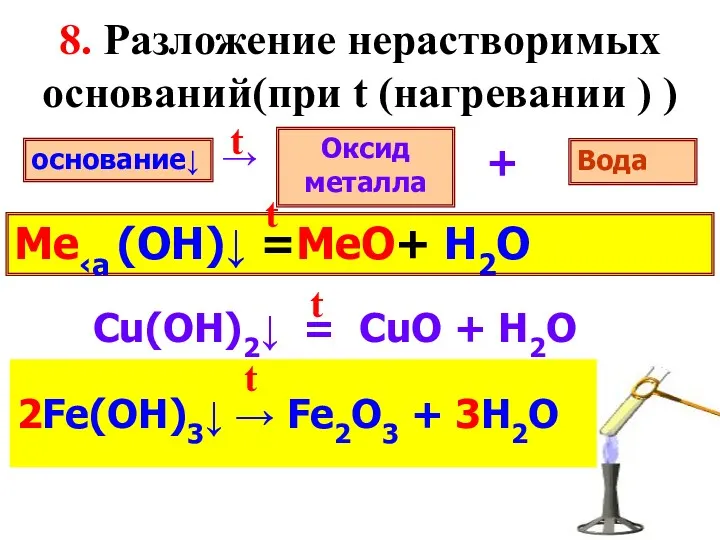
- 11. → Fe(OH)3↓ → … + … основание↓ Оксид металла Вода + 8. Разложение нерастворимых оснований(при t
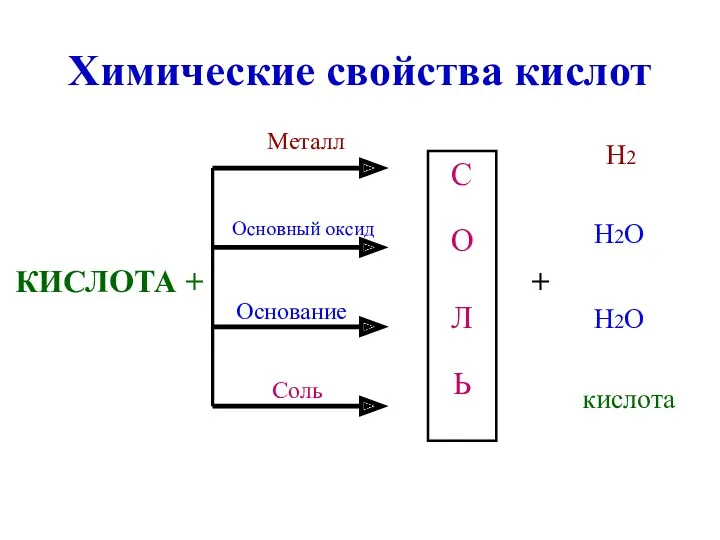
- 12. Химические свойства кислот КИСЛОТА + С О Л Ь Металл Основный оксид Основание Соль + Н2
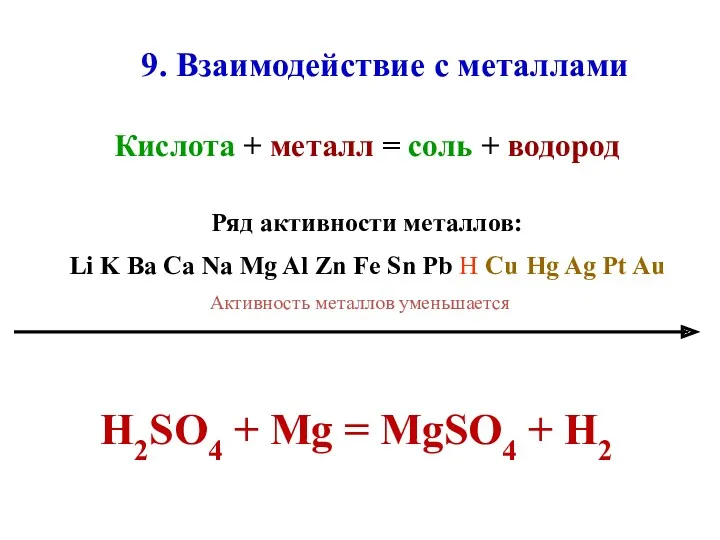
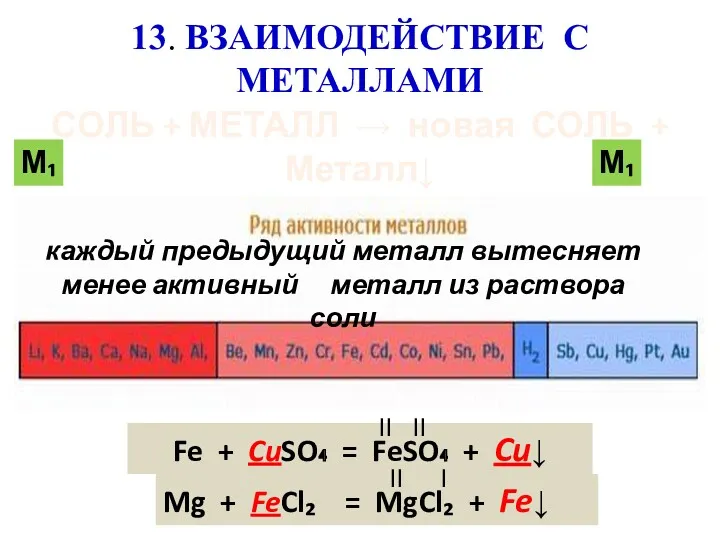
- 13. 9. Bзаимодействие с металлами Кислота + металл = соль + водород Ряд активности металлов: Li K
- 14. Кислота + основной оксид = соль + вода 10.Bзаимодействие с основными оксидами 2HCl + CuO =
- 15. Кислота + основание = соль + вода 11.Bзаимодействие с основаниями HBr + KOH = KBr +
- 16. Кислота 1 + соль1 = соль2 + Кислота 2 12.Взаимодействие с солями слабых кислот H2SO4 +
- 17. Химические свойства солей + металл → + кислота → + основание → + соль → разложение
- 18. 13. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ СОЛЬ + МЕТАЛЛ → новая СОЛЬ + Металл↓ каждый предыдущий металл вытесняет
- 19. 14. Взаимодействие с кислотами соль₁ + кислота₁ → соль₂ + кислота₂ (сильная кислота) (более слабая кислота)
- 20. 15. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ соль₁ +основание₁ = соль₂ +основание₂↓ CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄
- 21. 16. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ соль₁ +соль₂= новая соль₁↓+ новая соль₂ BaCl₂ + Na₂SO₄ = BaSO₄↓ +
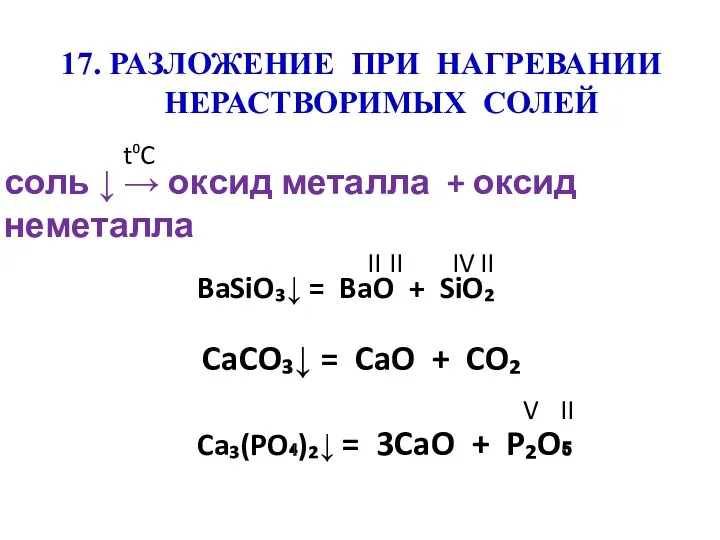
- 22. 17. РАЗЛОЖЕНИЕ ПРИ НАГРЕВАНИИ НЕРАСТВОРИМЫХ СОЛЕЙ соль ↓ → оксид металла + оксид неметалла t⁰C BaSiO₃↓
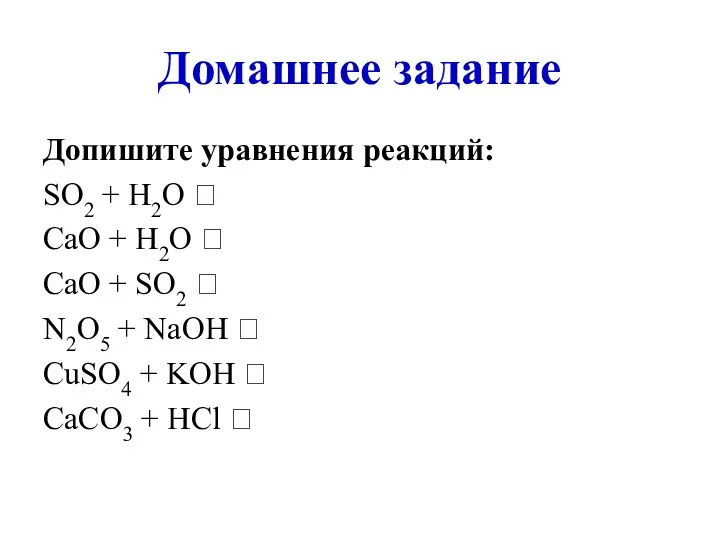
- 23. Домашнее задание Допишите уравнения реакций: SO2 + H2O ? CaO + H2O ? CaO + SO2
- 25. Скачать презентацию











 Сварочная робототехника
Сварочная робототехника Анализ причин аварий строительных конструкций. Реконструкция. Лекция 1
Анализ причин аварий строительных конструкций. Реконструкция. Лекция 1 Антон Павлович Чехов
Антон Павлович Чехов Страна городов
Страна городов Пальчиковая гимнастика в рисунках и стихах.
Пальчиковая гимнастика в рисунках и стихах. Градусная сетка
Градусная сетка Тест по истории искусства XIX века
Тест по истории искусства XIX века Каркасно-тентовое производство
Каркасно-тентовое производство Новинки электронных технологий представленные осенью 2019 года
Новинки электронных технологий представленные осенью 2019 года Документы для заселения в общежития КФУ
Документы для заселения в общежития КФУ Готовность к школе
Готовность к школе викторина по теме Культура бурятского народа для 5-6 классов.
викторина по теме Культура бурятского народа для 5-6 классов. Причастие как часть речи
Причастие как часть речи Государственное регулирование. Основы коммерческой деятельности
Государственное регулирование. Основы коммерческой деятельности Библиотечно-библиографическая классификация
Библиотечно-библиографическая классификация Презентация для изучения словарных слов (овощи). 3 класс
Презентация для изучения словарных слов (овощи). 3 класс Samsung - Расшифровка моделей
Samsung - Расшифровка моделей Богословие IV века. Святой Кирилл Иерусалимский (315-387 годы)
Богословие IV века. Святой Кирилл Иерусалимский (315-387 годы) Волейбол. Встречная передача и прием мяча сверху и снизу. Верхняя прямая подача, прием с подачи
Волейбол. Встречная передача и прием мяча сверху и снизу. Верхняя прямая подача, прием с подачи Фридрих Вильгельм Йозеф фон Шеллинг
Фридрих Вильгельм Йозеф фон Шеллинг Традиции и обычаи Индии.
Традиции и обычаи Индии. Тесты
Тесты Классификация научных исследований. Наука и научный метод
Классификация научных исследований. Наука и научный метод Раймон Клод Фердинанд Арон
Раймон Клод Фердинанд Арон Тіс тіндерінің тісжегіден басқа аурулары
Тіс тіндерінің тісжегіден басқа аурулары Произведения А.И. Солженицына
Произведения А.И. Солженицына урок безопасности
урок безопасности Образ помещика. Плюшкин. Мертвые души
Образ помещика. Плюшкин. Мертвые души