Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания о коллигативных свойствах растворов, осмосе, осмотическом давлении. РАЗВИВАЮЩАЯ: расширить кругозор обучающихся
- 3. У растворов имеется ряд свойств, которые не зависят от природы растворенного вещества и растворителя, а определяются,
- 4. Коллигативные свойства растворов К ним относятся: понижение давления насыщенного пара над раствором по сравнению с чистым
- 5. Законы Рауля описывают влияние растворенного вещества на физические свойства растворителя. В состоянии термодинамического равновесия (∆G =
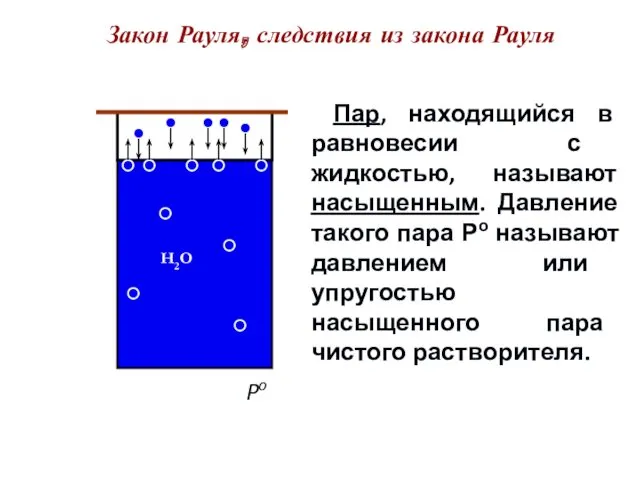
- 6. Закон Рауля, следствия из закона Рауля Po « Пар, находящийся в равновесии с жидкостью, называют насыщенным.
- 7. ↑t ↑ Po H2O: 00C – 4,6 мм рт. ст. 200C – 17,4 мм рт. ст.
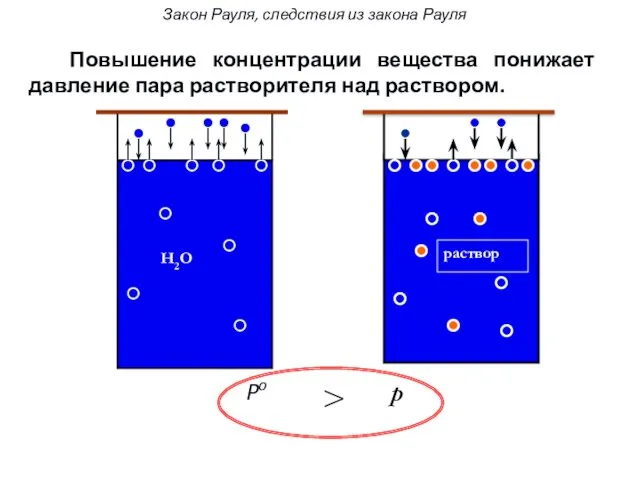
- 8. Po p > Закон Рауля, следствия из закона Рауля Повышение концентрации вещества понижает давление пара растворителя
- 9. Закон Рауля Относительное понижение давления насыщенного пара растворителя над раствором нелетучего электролита равно молярной (мольной) доле
- 10. Математическое выражение закона: , где Po – давление пара над чистым растворителем, Па; Р – давление
- 11. Для растворов электролитов в уравнение Рауля вводится изотонический коэффициент Вант-Гоффа. , где Ni – число частиц
- 12. Например, AlCl3 Al+3 + 3Cl-, i = 4/1 = 4 Для растворов неэлектролитов Ni = Nо,
- 13. Величина изотонического коэффициента зависит от степени диссоциации α (в долях от единицы) и числа дочерних частиц
- 14. Следствия из закона Рауля 1. Повышение температуры кипения разбавленных растворов неэлектролитов по сравнению с чистым растворителем
- 15. 2. Понижение температуры замерзания разбавленных растворов неэлектролитов по сравнению с чистым растворителем прямо пропорционально моляльной концентрации
- 16. Эбуллиометрические и криоскопические константы зависят только от природы растворителя и не зависят от природы растворенного вещества
- 17. Следствия из закона Рауля применяют в физико-химических методах исследования. Эбулиоскопия (от лат. ebulio – вскипаю) –
- 18. Следствия из закона Рауля Криоскопия – физико-химический метод исследования, основанный на измерении разности между температурой замерзания
- 19. Автоматический криоскопический осмометр измеряет тотальную осмолярность водных растворов. Удобен для использования в палатах интенсивной терапии и
- 20. Эти методы используются для определения: 1.Значения криоскопической константы для веществ с известной молекулярной массой. 2. Моляльной
- 21. Молярные массы (г ∙ моль-1) растворенных веществ-неэлектролитов рассчитываются по формулам: Mр.в. = E∙mр.в.∙1000 / ΔТкип.∙mр-ль, Mр.в.
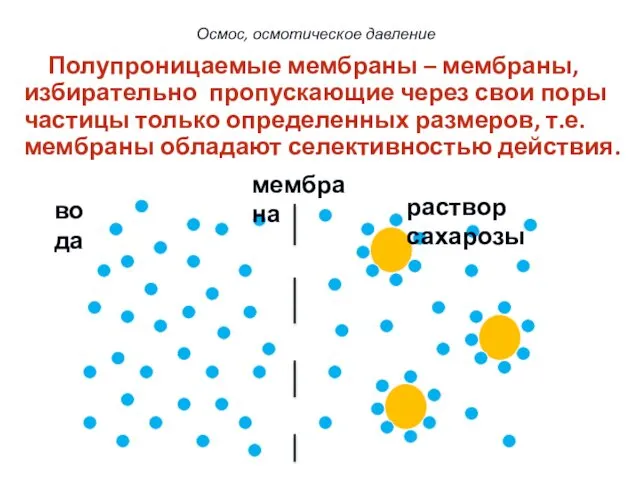
- 22. Осмосом называют преимущественно одностороннюю диффузию молекул растворителя (например, воды) через полупроницаемую мембрану из раствора с меньшей
- 23. мембрана вода раствор сахарозы 6 Осмос, осмотическое давление Полупроницаемые мембраны – мембраны, избирательно пропускающие через свои
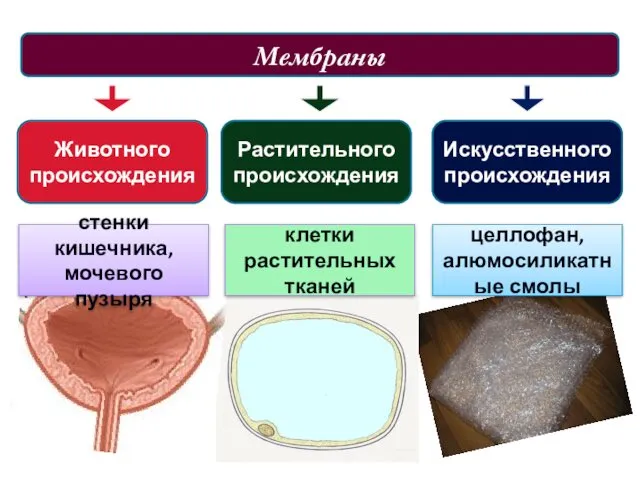
- 24. Мембраны Животного происхождения стенки кишечника, мочевого пузыря Растительного происхождения Искусственного происхождения клетки растительных тканей целлофан, алюмосиликатные
- 25. Осмос, осмотическое давление Мембраны животного происхождения свободно пропускают неорганические ионы и низкомолекулярные вещества, а задерживают высокомолекулярные
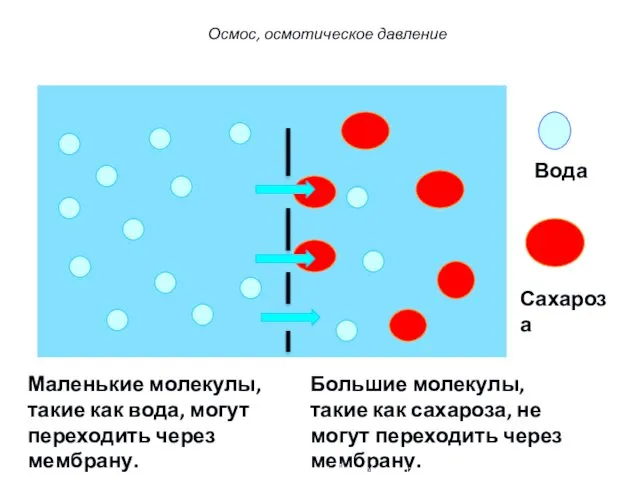
- 26. Вода Сахароза Маленькие молекулы, такие как вода, могут переходить через мембрану. Большие молекулы, такие как сахароза,
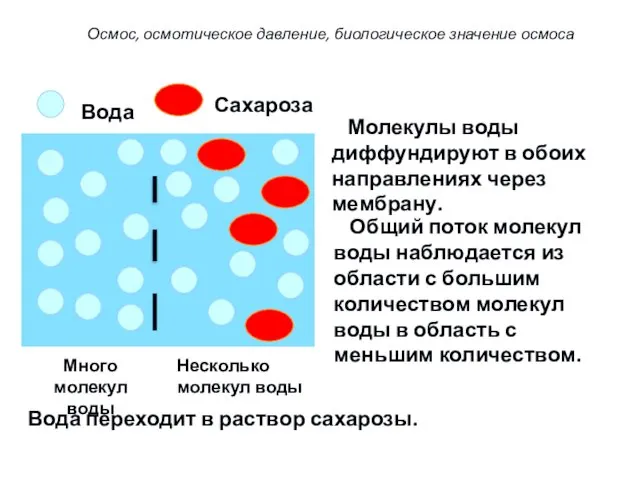
- 27. Молекулы воды диффундируют в обоих направлениях через мембрану. Общий поток молекул воды наблюдается из области с
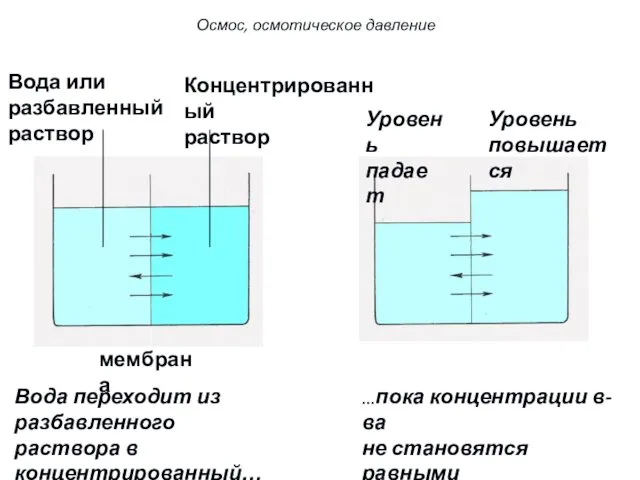
- 28. Вода или разбавленный раствор Концентрированный раствор мембрана Вода переходит из разбавленного раствора в концентрированный… Уровень повышается
- 29. Осмос, осмотическое давление С точки зрения термодинамики движущей силой осмоса является стремление системы к выравниванию свойств,
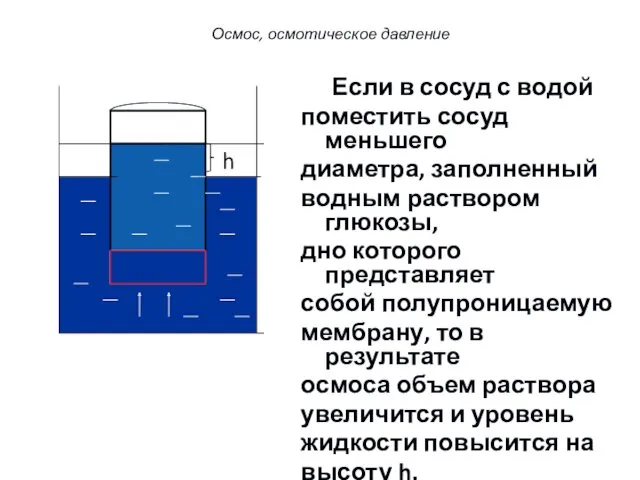
- 30. Если в сосуд с водой поместить сосуд меньшего диаметра, заполненный водным раствором глюкозы, дно которого представляет
- 31. При этом создается дополнительное гидростатическое давление столба жидкости высотой h на мембрану и возрастает вероятность обратного
- 32. Осмотическим давлением раствора называют величину, измеряемую минимальным гидростатическим давлением, которое нужно приложить к мембране со стороны
- 33. Осмотическое давление рассчитывается по уравнению Вант-Гоффа (1887 г.) Ученый рассмотрел поведение частиц вещества в растворе аналогично
- 34. Теоретическое выражение осмотического Уравнение осмотического давления (π) Вант-Гоффа: Если учесть, что то получим или Осмос, осмотическое
- 35. , где π – осмотическое давление, Па R - универсальная газовая постоянная, R = 8,314Дж∙моль-1∙К-1 Т
- 36. Для расчета осмотического давления растворов электролитов вводят изотонический коэффициент Вант-Гоффа: Осмотическое давление в растворе электролита зависит
- 37. В растворах высокомолекулярных веществ осмотическое давление рассчитывают по уравнению Галлера: , где СВМВ – весовая концентрация
- 38. Осмос играет огромную роль в организме. Благодаря осмосу, регулируется поступление воды в клетку и межклеточные структуры.
- 39. Осмос является одним из механизмов мембранного потенциала клетки: , где Емембрана – мембранный потенциал клетки, мВ;
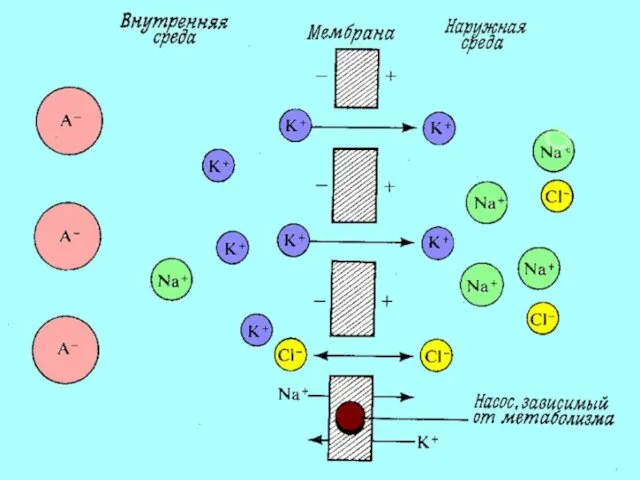
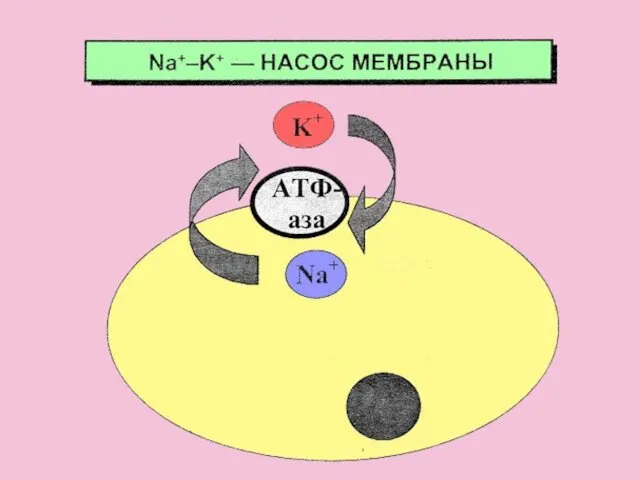
- 40. Основной причиной возникновения потенциала клетки является неравномерное распределение ионов калия и натрия между содержимым клетки и
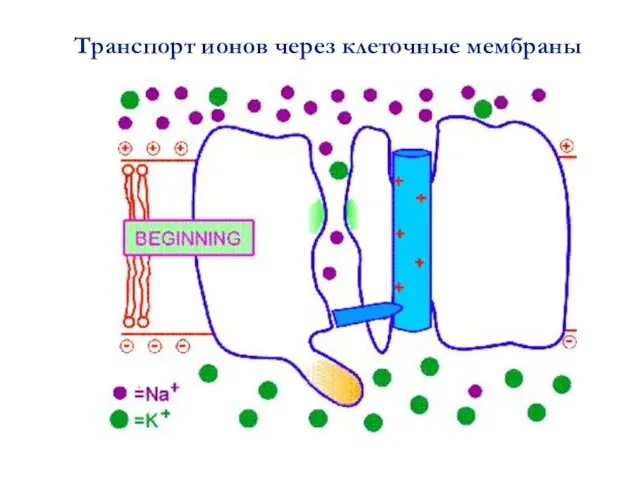
- 43. Транспорт ионов через клеточные мембраны
- 44. Осмотический градиент, определяющий собой силу, с которой вода всасывается в клетку, численно равен разности между осмотическим
- 45. Растворы Изотонические Растворы, имеющие одинаковое осмотическое давление Гипертонические Гипотонические Раствор с большим осмотическим давлением по отношению
- 46. 1. Если живую клетку поместить в изотонический раствор, то клетка сохраняет свой размер и нормально функционирует.
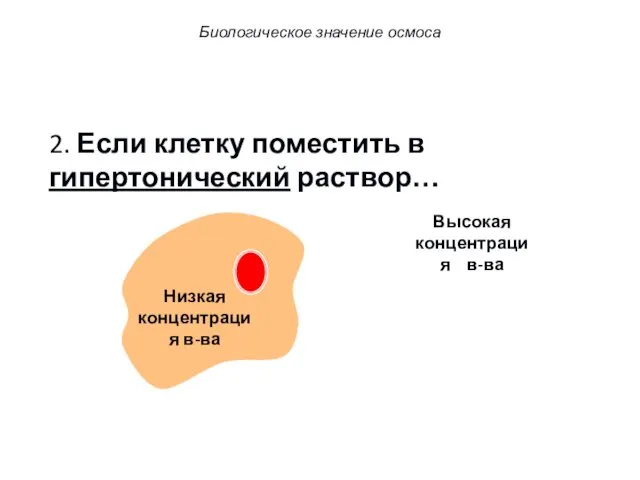
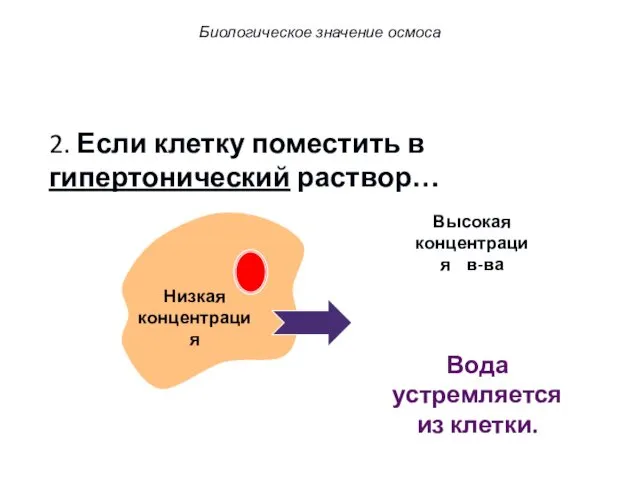
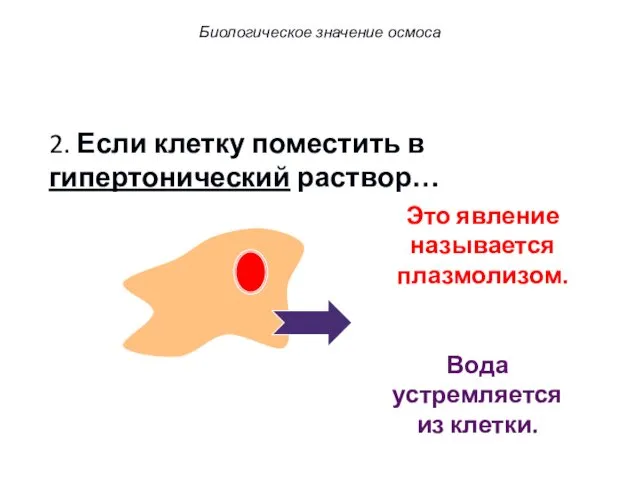
- 47. 2. Если клетку поместить в гипертонический раствор… Биологическое значение осмоса
- 48. 2. Если клетку поместить в гипертонический раствор… Higher concentration Низкая концентрация в-ва Высокая концентрация в-ва Биологическое
- 49. 2. Если клетку поместить в гипертонический раствор… Higher concentration Низкая концентрация Высокая концентрация в-ва Вода устремляется
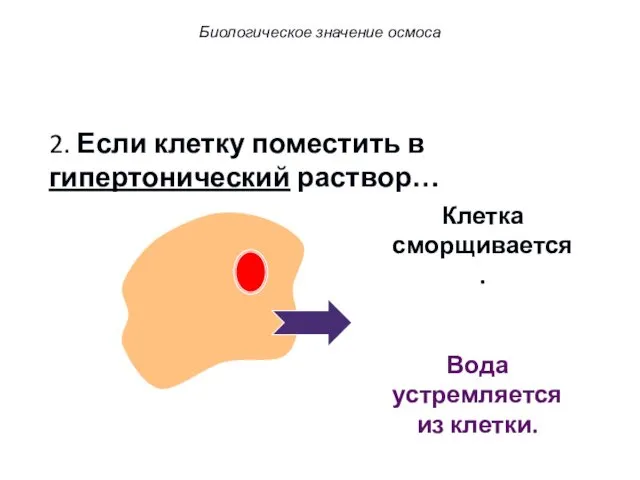
- 50. 2. Если клетку поместить в гипертонический раствор… Вода устремляется из клетки. Клетка сморщивается. Биологическое значение осмоса
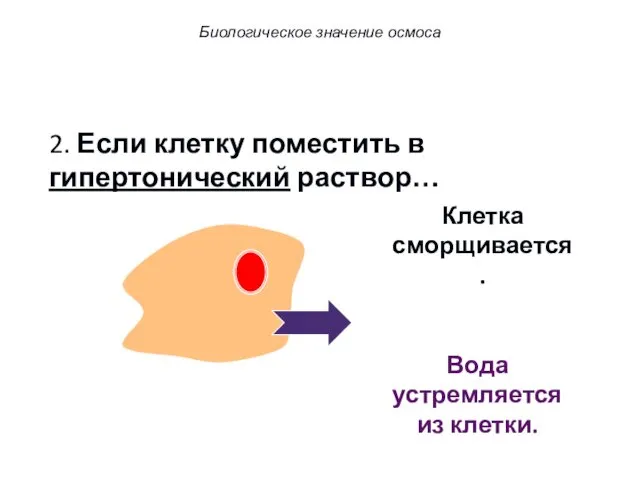
- 51. 2. Если клетку поместить в гипертонический раствор… Вода устремляется из клетки. Клетка сморщивается. Биологическое значение осмоса
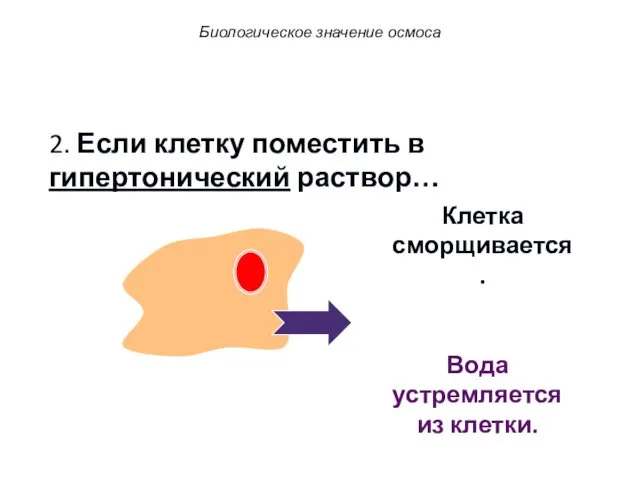
- 52. 2. Если клетку поместить в гипертонический раствор… Вода устремляется из клетки. Клетка сморщивается. Биологическое значение осмоса
- 53. 2. Если клетку поместить в гипертонический раствор… Вода устремляется из клетки. Клетка сморщивается. Биологическое значение осмоса
- 54. 2. Если клетку поместить в гипертонический раствор… Вода устремляется из клетки. Это явление называется плазмолизом. Биологическое
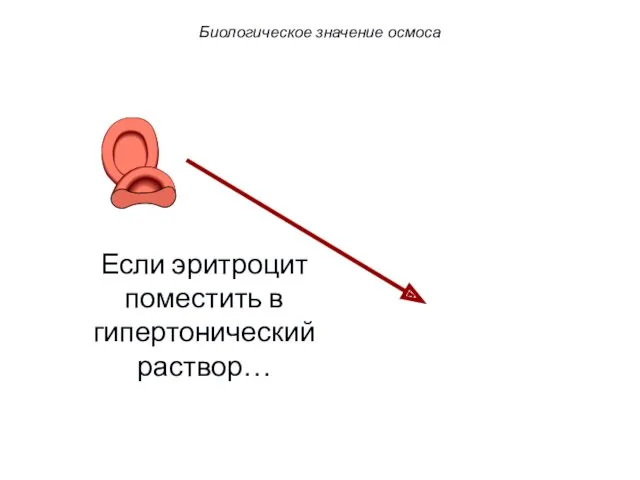
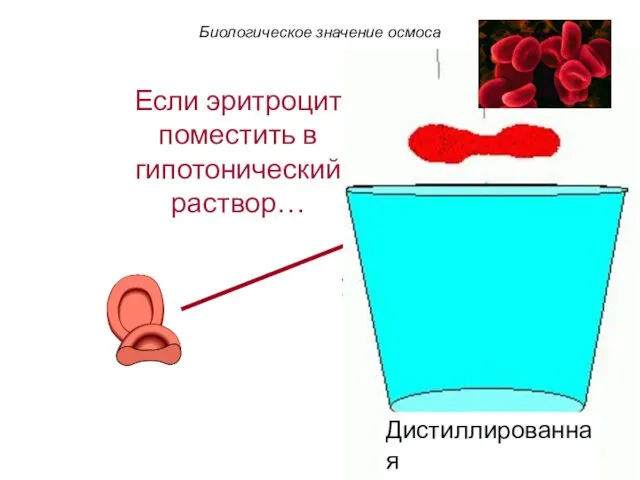
- 55. Если эритроцит поместить в гипертонический раствор… Биологическое значение осмоса
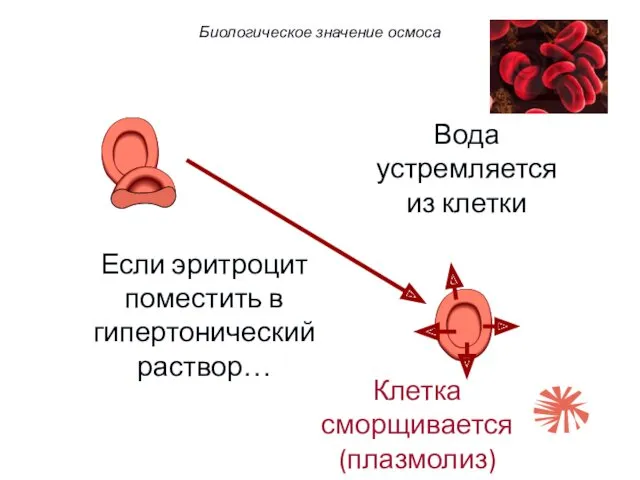
- 56. Если эритроцит поместить в гипертонический раствор… Вода устремляется из клетки Клетка сморщивается (плазмолиз) Биологическое значение осмоса
- 57. Биологическое значение осмоса В некоторых случаях плазмолиз является обратимым процессом, т.е. возможен деплазмолиз. Гипертонические растворы соли
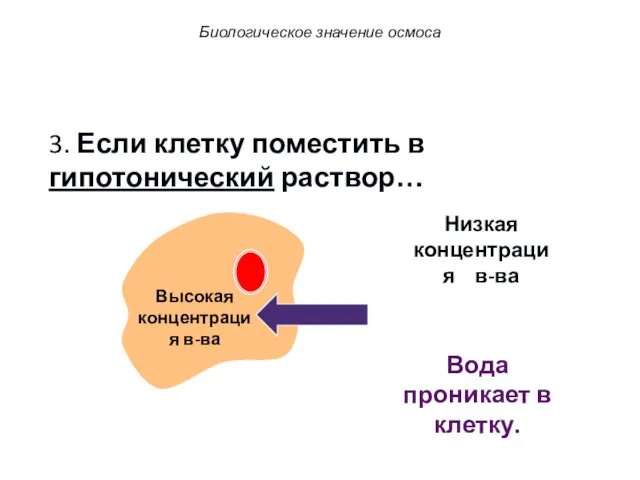
- 58. 3. Если клетку поместить в гипотонический раствор… Биологическое значение осмоса
- 59. 3. Если клетку поместить в гипотонический раствор… Низкая концентрация в-ва Высокая концентрация в-ва Вода проникает в
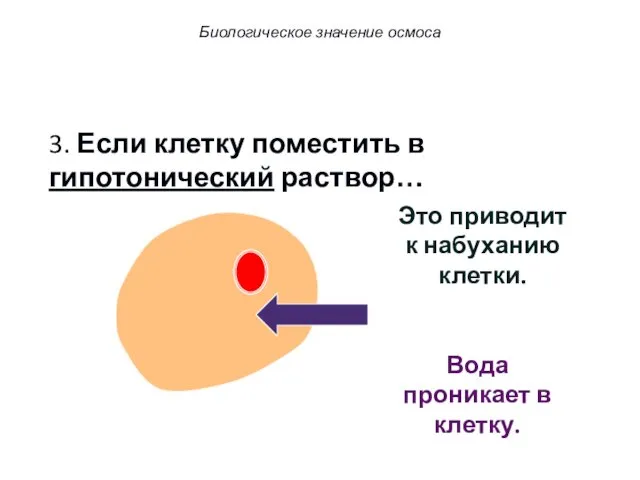
- 60. 3. Если клетку поместить в гипотонический раствор… Вода проникает в клетку. Это приводит к набуханию клетки.
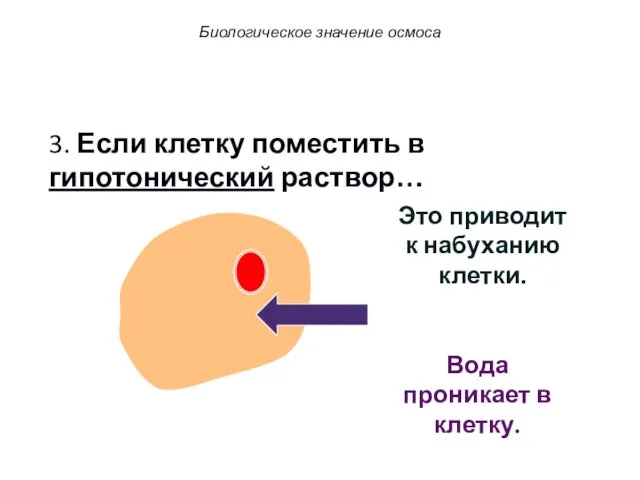
- 61. 3. Если клетку поместить в гипотонический раствор… Вода проникает в клетку. Это приводит к набуханию клетки.
- 62. 3. Если клетку поместить в гипотонический раствор… Вода проникает в клетку. Это приводит к набуханию клетки.
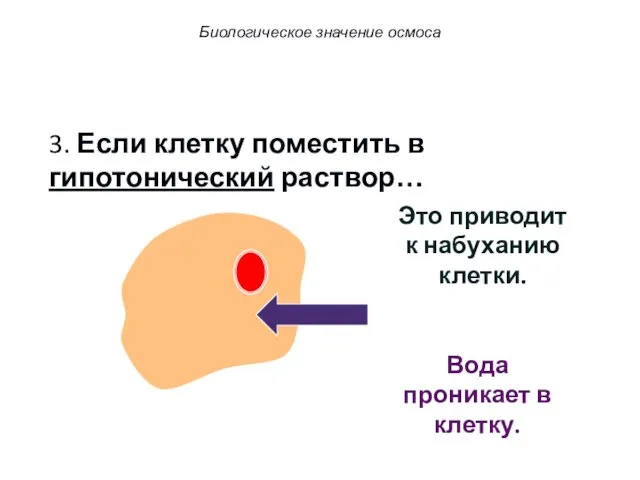
- 63. 3. Если клетку поместить в гипотонический раствор… Вода проникает в клетку путем осмоса. Это явление называют
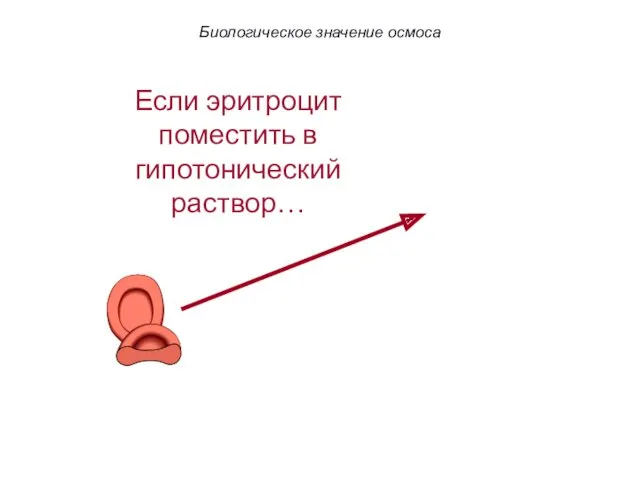
- 64. Если эритроцит поместить в гипотонический раствор… Биологическое значение осмоса
- 65. Если эритроцит поместить в гипотонический раствор… Вода устремляется в клетку. Оболочка клетки разрывается (гемолиз). Биологическое значение
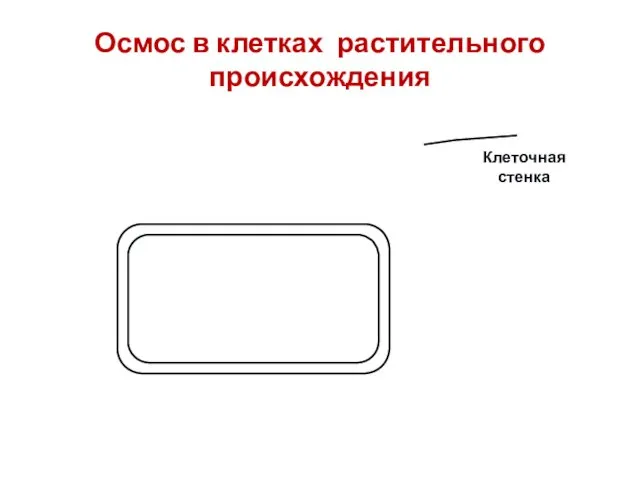
- 66. Клеточная стенка Осмос в клетках растительного происхождения
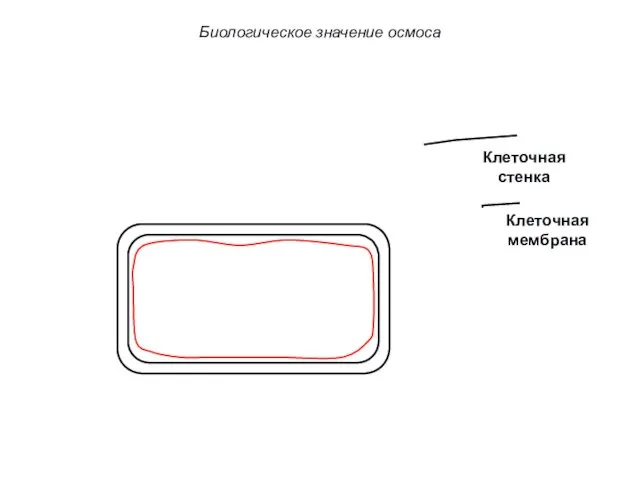
- 67. Клеточная стенка Клеточная мембрана Биологическое значение осмоса
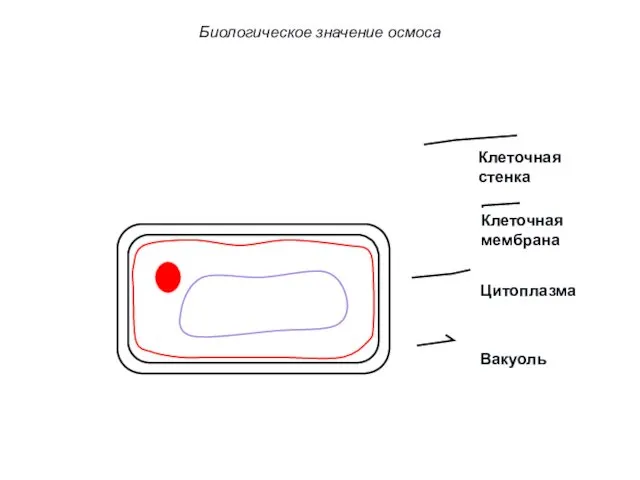
- 68. Клеточная стенка Клеточная мембрана Цитоплазма Вакуоль Биологическое значение осмоса
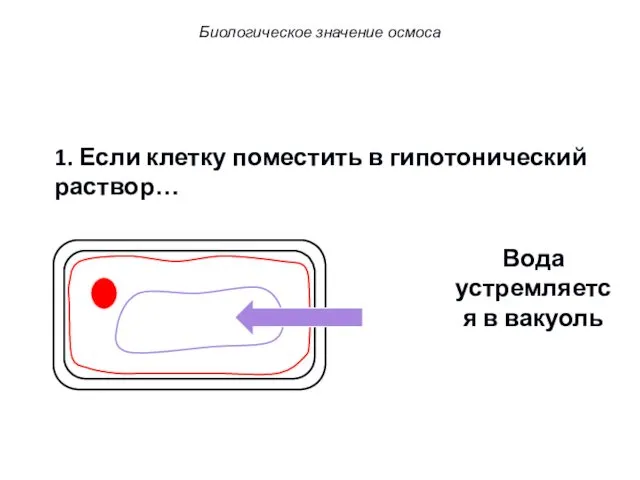
- 69. 1. Если клетку поместить в гипотонический раствор… Вода устремляется в вакуоль Биологическое значение осмоса
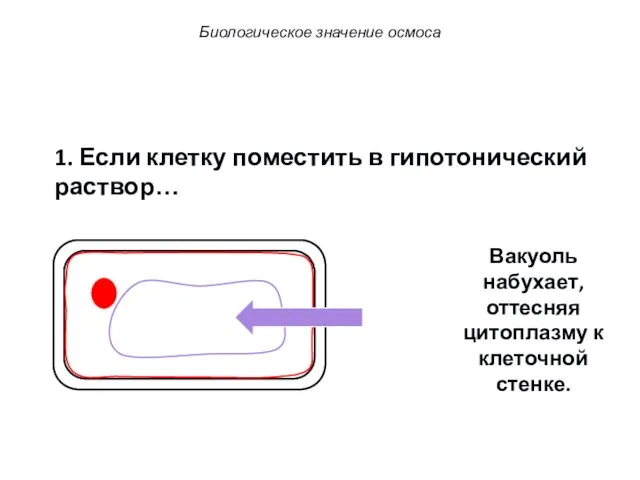
- 70. 1. Если клетку поместить в гипотонический раствор… Вакуоль набухает, оттесняя цитоплазму к клеточной стенке. Биологическое значение
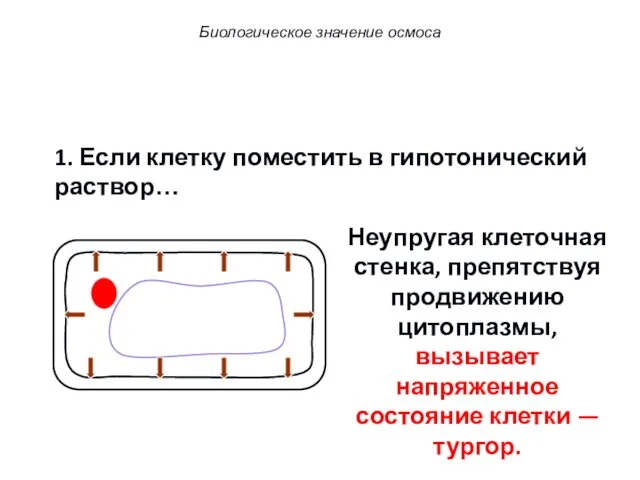
- 71. 1. Если клетку поместить в гипотонический раствор… Неупругая клеточная стенка, препятствуя продвижению цитоплазмы, вызывает напряженное состояние
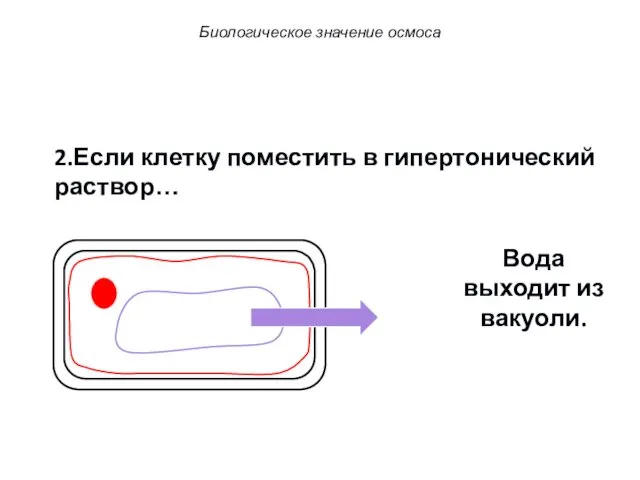
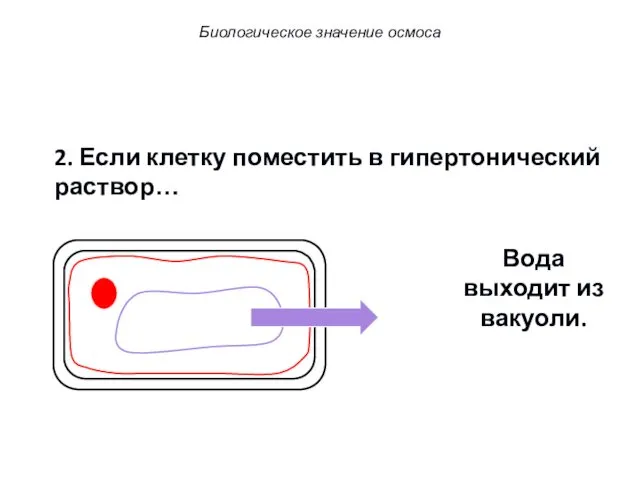
- 72. 2.Если клетку поместить в гипертонический раствор… Вода выходит из вакуоли. Биологическое значение осмоса
- 73. 2. Если клетку поместить в гипертонический раствор… Вода выходит из вакуоли. Биологическое значение осмоса
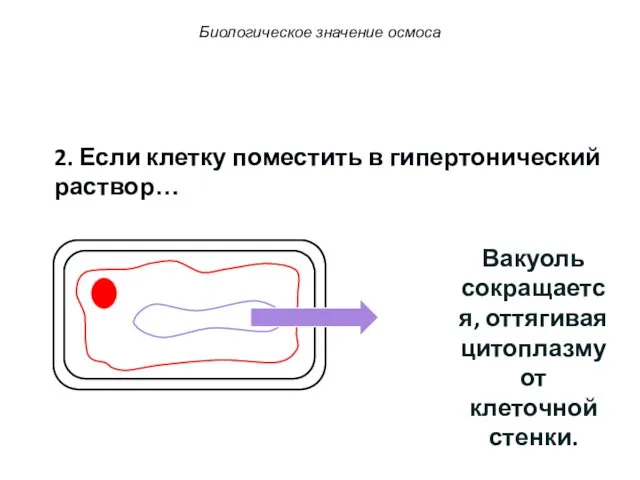
- 74. 2. Если клетку поместить в гипертонический раствор… Вакуоль сокращается, оттягивая цитоплазму от клеточной стенки. Биологическое значение
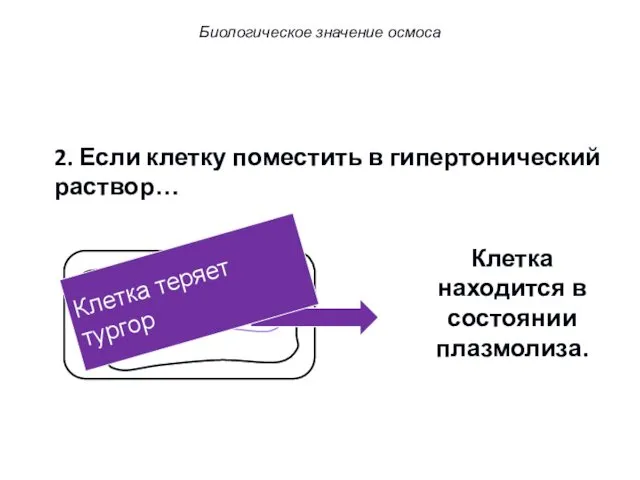
- 75. 2. Если клетку поместить в гипертонический раствор… Клетка находится в состоянии плазмолиза. Клетка теряет тургор Биологическое
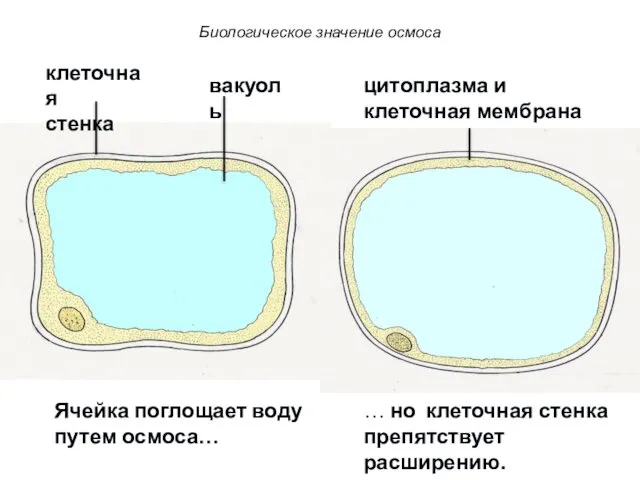
- 76. клеточная стенка цитоплазма и клеточная мембрана вакуоль Ячейка поглощает воду путем осмоса… … но клеточная стенка
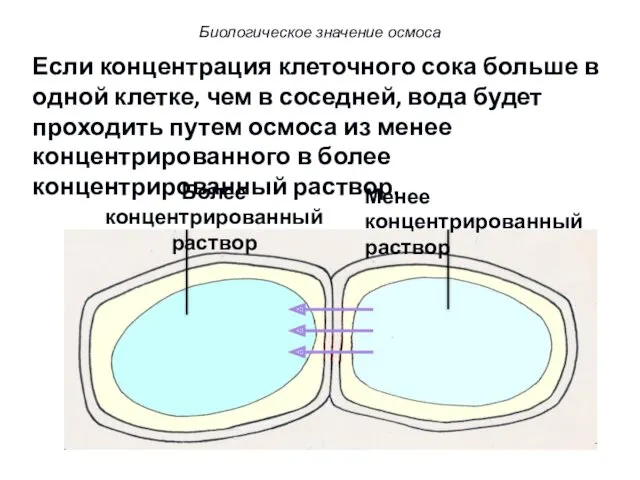
- 77. Если концентрация клеточного сока больше в одной клетке, чем в соседней, вода будет проходить путем осмоса
- 78. Эти клетки страдают от нехватки воды. Клетки наполнены водой путем осмоса. 21 ПЛАЗМОЛИЗ Биологическое значение осмоса
- 79. Часть осмотического давления крови, обусловленное присутствием в ней высокомолекулярных веществ (главным образом, белков), называют онкотическим давлением.
- 80. Онкотическое давление составляет примерно 0,5% от величины осмотического давления крови и равно 2,5-3,9 кПа. Оно играет
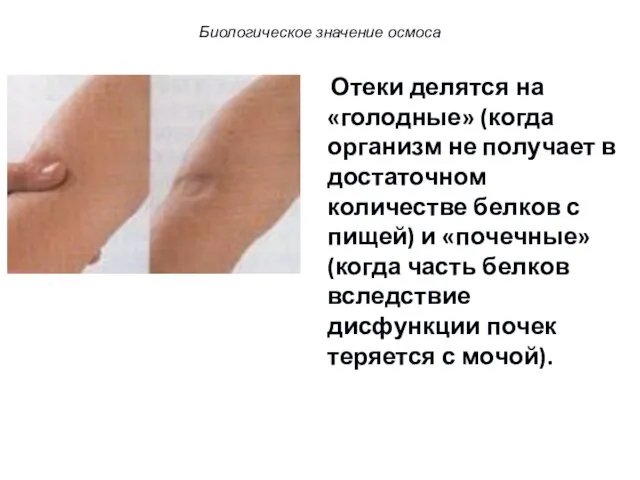
- 81. Отеки делятся на «голодные» (когда организм не получает в достаточном количестве белков с пищей) и «почечные»
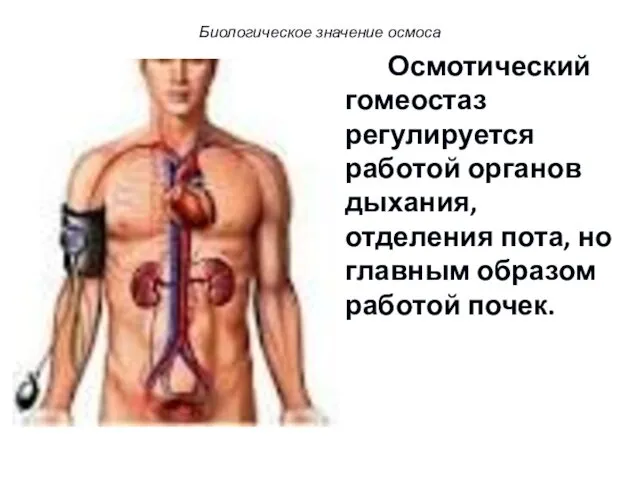
- 82. Осмотический гомеостаз регулируется работой органов дыхания, отделения пота, но главным образом работой почек. Биологическое значение осмоса
- 84. Скачать презентацию










































 Ханс Кристиан Андерсен (2 апреля 1805 г.)
Ханс Кристиан Андерсен (2 апреля 1805 г.) Красота и здоровье
Красота и здоровье Урок-презентация кронштадт
Урок-презентация кронштадт Знакомство с персональным компьютером
Знакомство с персональным компьютером Проектная деятельность в детском саду
Проектная деятельность в детском саду Inverter
Inverter Клиент-серверная архитектура
Клиент-серверная архитектура Имя прилагательное.Суффиксы прилагательных
Имя прилагательное.Суффиксы прилагательных Три состояния вещества
Три состояния вещества Квалификационный экзамен: Установка и обслуживание программного обеспечения, серверов, периферийных устройств и оборудования
Квалификационный экзамен: Установка и обслуживание программного обеспечения, серверов, периферийных устройств и оборудования Творческое задание интернет-проекта Путешествие в мир химии
Творческое задание интернет-проекта Путешествие в мир химии Электрические явления. Повторение. 8 класс
Электрические явления. Повторение. 8 класс Лес - богатство наше
Лес - богатство наше Л.Н.Толстой После бала
Л.Н.Толстой После бала Стандартизація продукції тваринництва
Стандартизація продукції тваринництва Искусство Древнй Греции Эллинизм
Искусство Древнй Греции Эллинизм Николай Васильевич Гоголь 20 марта 1809 - 21 февраля 1852
Николай Васильевич Гоголь 20 марта 1809 - 21 февраля 1852 Теоретические направления в социологии
Теоретические направления в социологии Перемешивание в жидких средах. Лекция 3
Перемешивание в жидких средах. Лекция 3 Школьные будни Диск
Школьные будни Диск Некроз. Апоптоз. Обучающая программа
Некроз. Апоптоз. Обучающая программа Мастер-класс по теме Защита методической разработки
Мастер-класс по теме Защита методической разработки Влияние психоэмоционального состояния юных хоккеистов 12-13 лет на спортивную успешность
Влияние психоэмоционального состояния юных хоккеистов 12-13 лет на спортивную успешность Команды получения справочной информации об объекте. Возможности команды Массив Дуги Autodesk AutoCAD
Команды получения справочной информации об объекте. Возможности команды Массив Дуги Autodesk AutoCAD Летняя гуманитарно-математическая школа. Семейный научно-познавательный лагерь Остров героев – 2020
Летняя гуманитарно-математическая школа. Семейный научно-познавательный лагерь Остров героев – 2020 Победа Диск
Победа Диск Бычок из сена
Бычок из сена Методология разработки программного обеспечения Microsoft Solution Framework
Методология разработки программного обеспечения Microsoft Solution Framework