Содержание
- 2. Литература Основная литература 1. Семенова, И. В. Коррозия и защита от коррозии [Текст]: учеб. пособие /
- 3. Литература Методическая литература 1. Лихачев В.А., Горева Т.В. Практикум по курсу «Химическое сопротивление материалов» [Текст]: учеб.
- 4. Тема 1 Коррозия железа и его сплавов в различных средах
- 5. рH 3 6 9 12 Рис. 1.3 Зависимость скорости коррозии железа от рН среды Влияние рН
- 6. Кислотная коррозия Переход в область кислотной коррозии сопровождается существенным увеличением скорости коррозии за счет: 1. растворения
- 7. Кислотная коррозия Слабые кислоты (борная, щавелевая, лимонная) при рН 5-6 достаточно концентрированные и способны растворить пленку
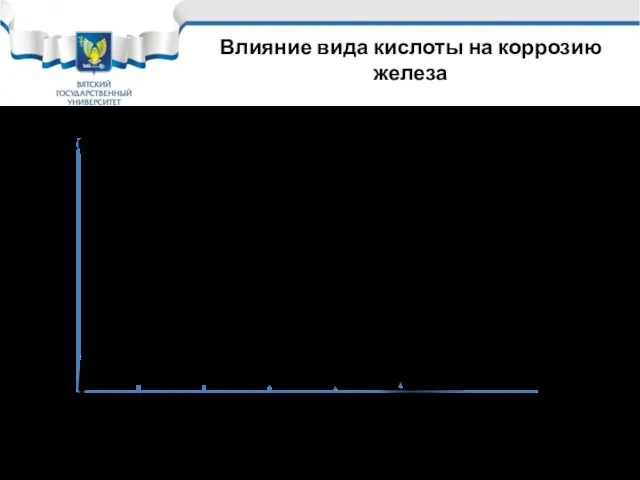
- 8. Влияние вида кислоты на коррозию железа Vкор 1 – НNO3 2- H2SO4 3 - HCl 1
- 9. Коррозия железа в наиболее распространенных кислотах Рассмотрим область низких и средних концентраций (до 37%). Такие кислоты
- 10. Травление сталей в растворах кислот Несмотря на самую высокую скорость коррозии железа в HNO3 и высокую
- 11. Травление сталей в различных кислотах H2SO4 плохо растворяет оксиды, но хорошо травит железо, поэтому травление в
- 12. Коррозия железа в HNO3 Азотная кислота (HNO3): максимальная скорость коррозии при 30% (Семенова 50%); далее пассивация
- 13. Коррозия железа в H2SO4 Максимальная скорость коррозии при концентрации 50-60% (Семенова 47-50%), далее начинает падать. Пассивация
- 14. Коррозия железа в H3РO4 Влияние концентрации кислоты сходно с влиянием ее в H2SO4 Максимальная скорость коррозии
- 15. Коррозия железа в HF До 50% углеродистые и низколегированные стали растворяются очень активно; При более высоких
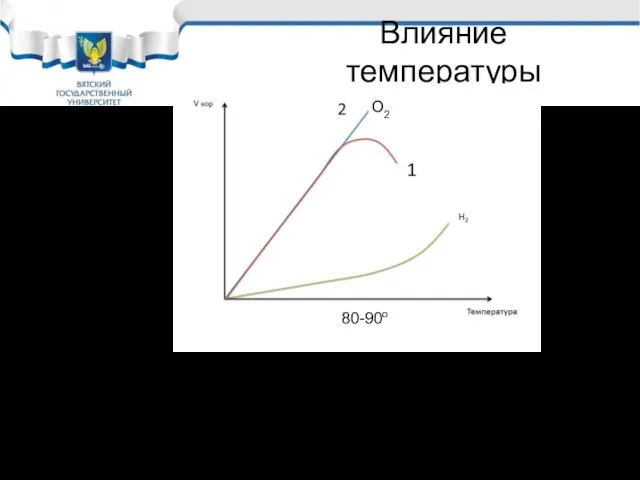
- 16. Влияние температуры Чем выше температура, тем выше скорость коррозии. Особенно сильно это влияние проявляется в НCl,
- 17. Влияние на коррозию сталей примесей 1000 500 S P Si 0,1N HCl Кm г/м2сутки 0,05 0,1
- 18. Влияние на коррозию стали вида обработки % HCl 0,02 0,08 Кm г/м2сутки 50 100 150 Прокат
- 19. Коррозия в нейтральных средах 1)Fe+ 2e+ H20 Fe(OH)2 + 2H+; Fe(OH)2 Fe(OH)3 2)O2+2H2O+4e 4OH- Вначале смесь
- 20. При наличии в атмосфере газов СО2, Н2S, SO2 в состав продуктов коррозии включаются соли FeSO4, FeCO3,
- 21. Влияние меди на коррозию стали в условиях открытой атмосферы 10Г2С1Д, 10ХСН2Д 09Г2Д, 15ГФ(Д)
- 22. Влияние ионов при подводной коррозии 1.Анионы: СО 3 -2, SO4-3 , SiO3-2 ,Cl- SO4-2 За счёт
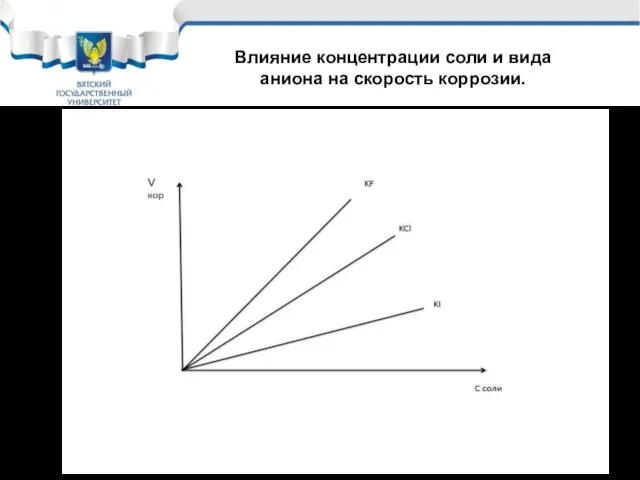
- 23. Влияние концентрации соли и вида аниона на скорость коррозии.
- 24. Влияние ионов 2.Катионы: NH4+ -является комплексообразователем, NO3- - может работать как дополнительный окислитель, а иногда пассиватор
- 25. Влияние температуры Скорость коррозии удваивается при изменении температуры на 30оС в открытой системе. Открытая система Закрытая
- 26. Коррозия в щелочах рН 11,5-13 Fe- 2e+ OH- Fe(OH)2 Fe(OH)3 Железо пассивируется, но пассивация идёт не
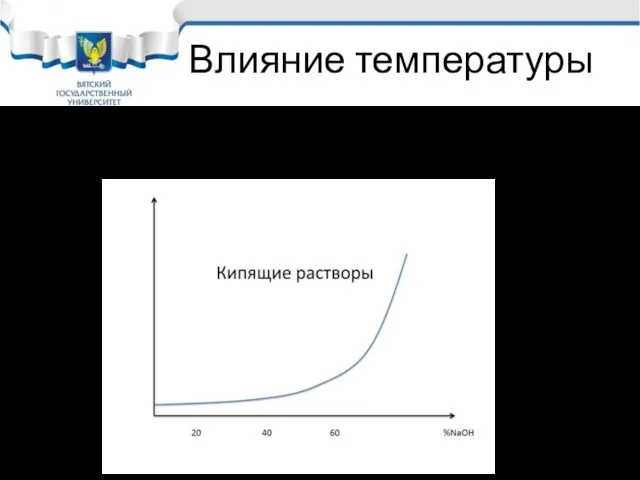
- 27. Влияние температуры Влияние температуры очень велико, особенно опасны кипящие растворы щелочи.
- 28. Наиболее опасными считаются кипящие растворы с концентрацией щелочи более 60%. Но за счёт двух реакций происходит
- 29. Щелочное коррозионное растрескивание Особенностью коррозии в концентрированных щелочах является появление в них коррозионного растрескивания под напряжением
- 30. Виды нержавеющих сталей Коррозионностойкие (нержавеющие) стали и сплавы делят на 5 групп: 1. Стали для слабоагрессивных
- 31. Вторая группа коррозионностойких (нержавеющих) сталей применяется в солевых средах при невысоких температурах, в частности при морской
- 32. Под средами со средней коррозионной агрессивностью понимают растворы солей при разных температурах, а также слабые растворы
- 33. Стали для применения в средах с повышенной коррозионной агрессивностью Эти стали разрабатывались с целью повышения химического
- 35. Скачать презентацию




























 Арабский халифат
Арабский халифат Тема 1.6.3
Тема 1.6.3 Русская народная сказка Иван-царевич и Серый волк
Русская народная сказка Иван-царевич и Серый волк Психические процессы, свойства, состояния
Психические процессы, свойства, состояния Кодирование информации
Кодирование информации Посёлки Смолеозёрный и Порт-Артур города Челябинска
Посёлки Смолеозёрный и Порт-Артур города Челябинска Блокадный дневник Тани Вассович
Блокадный дневник Тани Вассович Полимерные материалы
Полимерные материалы Гласные буквы
Гласные буквы Картины И.И. Шишкина
Картины И.И. Шишкина Российское движение школьников
Российское движение школьников Презентация Адаптационный период первоклассников. Итоги.
Презентация Адаптационный период первоклассников. Итоги. Повышение эффективности работы компрессорной станции Еты - Пуровского месторождения
Повышение эффективности работы компрессорной станции Еты - Пуровского месторождения Православные монастыри
Православные монастыри 3-1 (2)
3-1 (2) Декоративно-прикладное искусство. 5 класс
Декоративно-прикладное искусство. 5 класс Голышев В.С._ВКР
Голышев В.С._ВКР Презентация проекта рабочей программы кружковой деятельности по музыкальному образованию в ДОУ
Презентация проекта рабочей программы кружковой деятельности по музыкальному образованию в ДОУ ИЗО. Сказочный домик
ИЗО. Сказочный домик Шагает эра космоса вперёд.
Шагает эра космоса вперёд. Рыба мороженая
Рыба мороженая Николай Семёнович Лесков (1831-1895)
Николай Семёнович Лесков (1831-1895) Буддизм - третья мировая религия
Буддизм - третья мировая религия Деятельность дошкольной образовательной организации. Начало духовно-нравственного становления личности ребенка
Деятельность дошкольной образовательной организации. Начало духовно-нравственного становления личности ребенка СД и АГ
СД и АГ Примеры оформления докладов по корпоративной культуре. Программа деловой этики
Примеры оформления докладов по корпоративной культуре. Программа деловой этики Энергия электрического поля
Энергия электрического поля Сравнение чисел
Сравнение чисел