Содержание
- 2. Классификация химических реакций по виду энергии, инициирующей реакцию Фотохимические реакции. Их инициирует световая энергия Радиационные реакции.
- 3. Тепловой эффект химических реакций
- 4. Тепловой эффект химических реакций Количество теплоты, которое выделяется или поглощается в результате реакции, называют тепловым эффектом
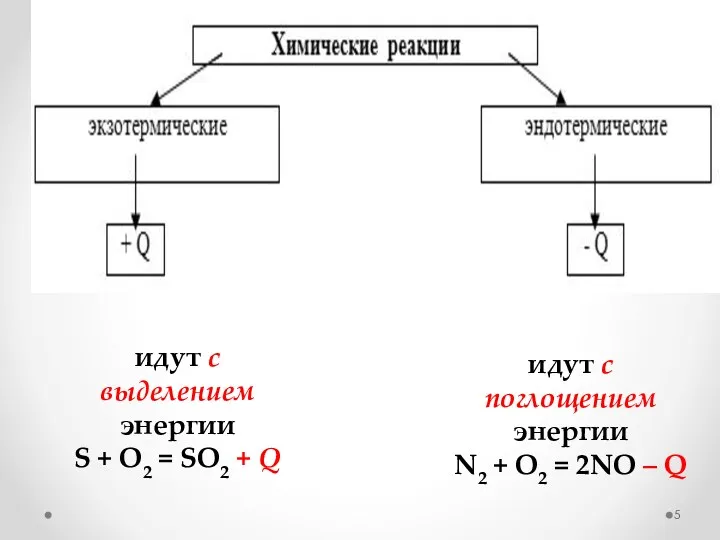
- 5. идут с выделением энергии S + O2 = SO2 + Q идут с поглощением энергии N2
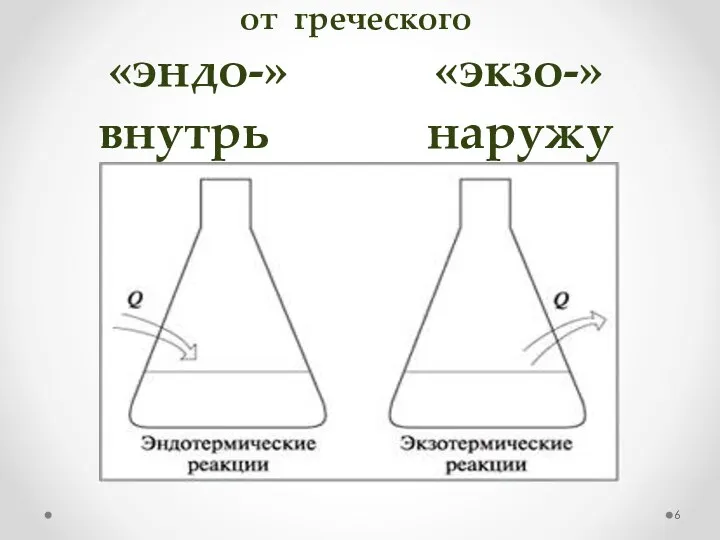
- 6. от греческого «эндо-» «экзо-» внутрь наружу
- 7. С + O2 → СO2 +394 кДж
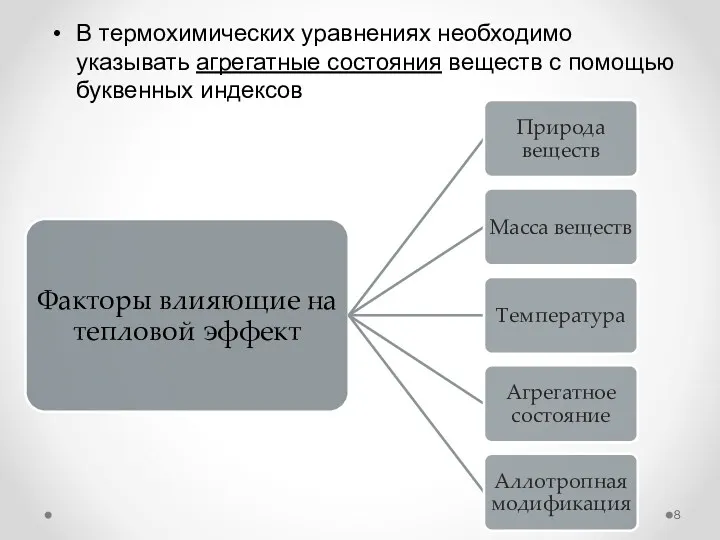
- 8. В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов
- 9. Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ. Существует два важнейших закона термохимии.
- 10. закон Лавуазье–Лапласа Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
- 11. Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом: Тепловой эффект реакции
- 12. Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Первый путь (одностадийный): 2 NaOH
- 13. Энтальпия Энтальпия - это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании.
- 14. Энтальпия и тепловой эффект противоположны по знаку При экзотермических реакциях, когда тепло выделяется, ∆Н отрицательно. При
- 15. H2(г) + Cl2(г)=2HCl(г) EH-H = 436 кДж/моль, ЕCl-Cl = 240 кДж/моль, EH-Cl=430 кДж/моль, Qp = 2
- 16. Для расчета тепловых эффектов реакций используют значения величин теплот образования всех участвующих в реакции химических соединений(
- 17. Как вычислить тепловой эффект реакции Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции
- 18. Задача При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой
- 19. Задачи При сгорании 7 г этилена выделяется 350 кДж теплоты. Определите тепловой эффект реакции. Термохимическое уравнение
- 21. Скачать презентацию










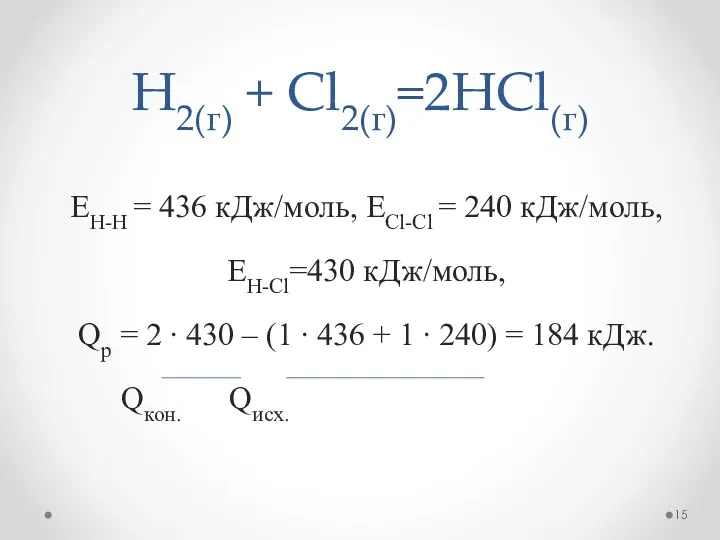




 Обеспечение надежности систем трубопроводного транспорта
Обеспечение надежности систем трубопроводного транспорта Презентация Народная японская кукла САРУБОБО
Презентация Народная японская кукла САРУБОБО Экологический турнир Умники и умницы
Экологический турнир Умники и умницы Способы восстановления деталей и сопряжений
Способы восстановления деталей и сопряжений Своя игра по сказкам русских и зарубежных писателей
Своя игра по сказкам русских и зарубежных писателей в царстве грибов
в царстве грибов Конкурс Социальная Звезда- 2018. Мальчишник -2018
Конкурс Социальная Звезда- 2018. Мальчишник -2018 Гроза, Островский 10 класс
Гроза, Островский 10 класс Раннесредневековые государства на территории Казахстана
Раннесредневековые государства на территории Казахстана Право в системе социальных норм
Право в системе социальных норм Технология приготовления блюд из тушеных овощей: Рагу из овощей
Технология приготовления блюд из тушеных овощей: Рагу из овощей Специальные способы сварки
Специальные способы сварки Всемирный формат школьных дебатов
Всемирный формат школьных дебатов Развитие произвольного внимания у детей дошкольного возраста с помощью графических диктантов
Развитие произвольного внимания у детей дошкольного возраста с помощью графических диктантов Разметка документов
Разметка документов Использование голосового помощника Маруся на уроках математики в 5 классе
Использование голосового помощника Маруся на уроках математики в 5 классе Почему ты лучше всего на свете
Почему ты лучше всего на свете Организм человека
Организм человека Головоломка пентамино
Головоломка пентамино Тема урока Путешественники древности. География 5 класс ФГОС .
Тема урока Путешественники древности. География 5 класс ФГОС . Гибкая черепица
Гибкая черепица Гражданско- патриотическое воспитание дошкольников через приобщение к труду.
Гражданско- патриотическое воспитание дошкольников через приобщение к труду. Зарождение централизованных государств в Европе
Зарождение централизованных государств в Европе Компании Citel
Компании Citel Райская Церковь
Райская Церковь Механизмы защиты прав и свобод человека
Механизмы защиты прав и свобод человека Урок химии в 10 классе по теме: Полимеры. Пластмассы. Волокна
Урок химии в 10 классе по теме: Полимеры. Пластмассы. Волокна Правила безопасности. Безопасность в доме
Правила безопасности. Безопасность в доме