Содержание
- 2. Учебники Цирельсон В.Г. Квантовая химия. Молекулы, молекулярные системы и твердые тела "БИНОМ. Лаборатория знаний" 2012. –
- 3. Рейтинг курса Экзамен – 40 баллов (20 б. – миним. к допуску) Практические работы – 30
- 4. Основные понятия Квантовая механика – т. раздел физики, описывающий движение и свойства микрочастиц (электронов, атомов, молекул).
- 5. Возникновение атомной физики V-IV в до н. э – Демокрит, Левкипп: понятие неделимой частицы (впоследствии «атом»)
- 6. Радиоактивность 1896 г. Антуан Анри Беккерель – для солей урана Радиоактивность – самопроизвольное превращение неустойчивых ядер
- 7. Изотопы (U, Th, Ac) 1899 - 1907г. Эрнест Резерфорд, Фредерик Содди Изотопы – разновидности одного и
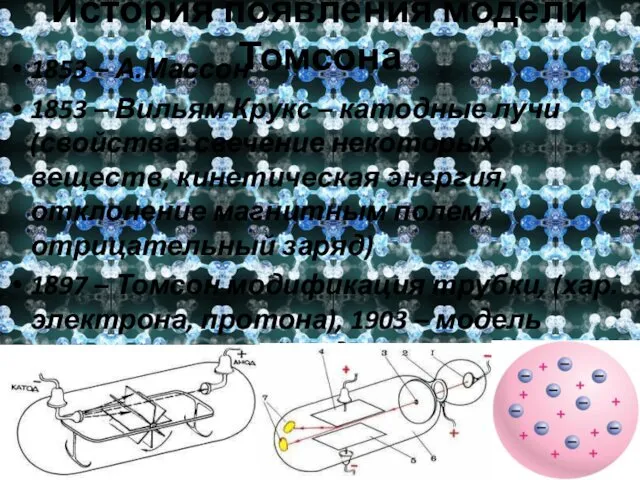
- 8. История появления модели Томсона 1853 – А.Массон 1853 – Вильям Крукс – катодные лучи (свойства: свечение
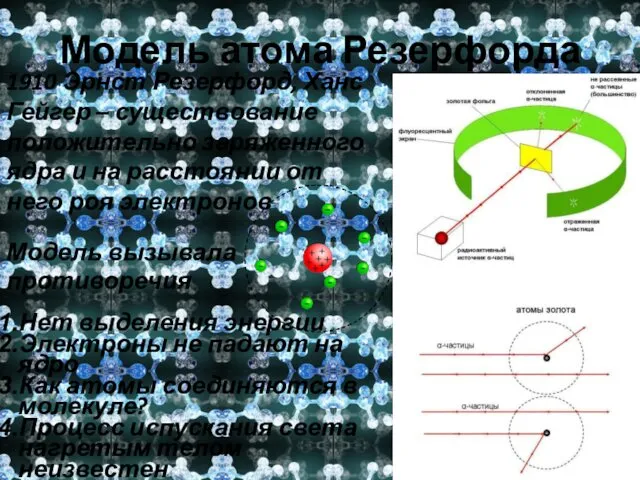
- 9. Модель атома Резерфорда 1910 Эрнст Резерфорд, Ханс Гейгер – существование положительно заряженного ядра и на расстоянии
- 10. Квантовая модель атома Бора 1913 – Нильс Бор на основе двух постулатов: В атоме существует несколько
- 11. Предпосылки квантовой теории атома 1910 г. Макс Планк связал элементарный квант (порцию света) с частотой электромагнитной
- 12. Квантовая модель атома Бора Уровни – электронные орбиты Подуровни составляют уровень Орбитали составляют подуровень Расположение электронов
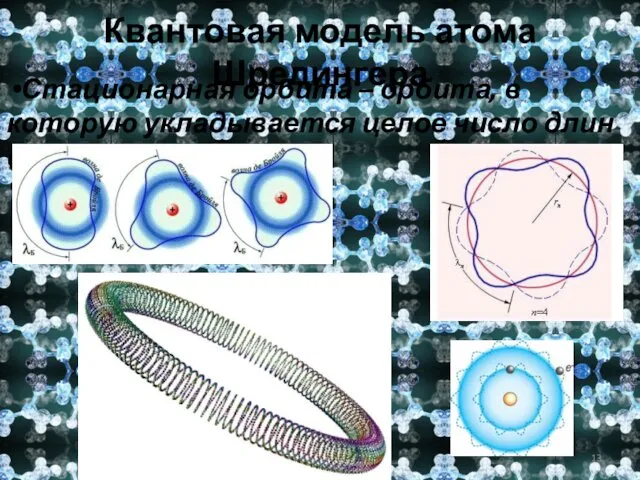
- 13. Квантовая модель атома Шредингера Стационарная орбита – орбита, в которую укладывается целое число длин волн электрона
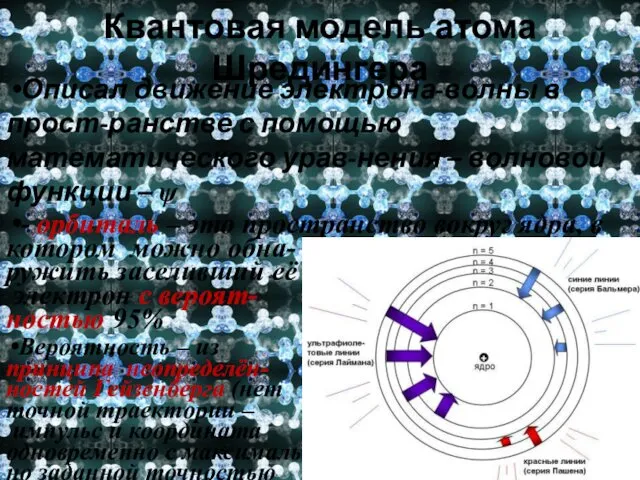
- 14. Квантовая модель атома Шредингера Описал движение электрона-волны в прост-ранстве с помощью математического урав-нения – волновой функции
- 15. Квантовая модель атома Шредингера Существование уровней, орбиталей различной формы
- 17. Скачать презентацию










 Презентация Один дома
Презентация Один дома Автоматизированные системы экспериментальных исследований (АСУЭ)
Автоматизированные системы экспериментальных исследований (АСУЭ) Разработка занятия по технике изонить. Первые шаги - угол.
Разработка занятия по технике изонить. Первые шаги - угол. Электроснабжение ремонтно-механического цеха
Электроснабжение ремонтно-механического цеха Фиброгастродуоденоскопия әдісі
Фиброгастродуоденоскопия әдісі Повторение изученного в разделе Фонетика. Орфоэпия. Графика. Орфография. Культура речи
Повторение изученного в разделе Фонетика. Орфоэпия. Графика. Орфография. Культура речи Персональный компьютер
Персональный компьютер Здоровьесберегающие технологии на уроках с испльзованием компьютера
Здоровьесберегающие технологии на уроках с испльзованием компьютера физкультминутка для глаз
физкультминутка для глаз Структура когнитивной науки, методы когнитивных дисциплин
Структура когнитивной науки, методы когнитивных дисциплин Снегирь на рябине. Объёмная аппликация
Снегирь на рябине. Объёмная аппликация 20230320_vrhr-ndpmnpm3ikivtjyrg
20230320_vrhr-ndpmnpm3ikivtjyrg Дымковская игрушка
Дымковская игрушка Буква Б
Буква Б Микропроцессорная техника
Микропроцессорная техника Экологическая игра в начальной школе
Экологическая игра в начальной школе Деловая карьера
Деловая карьера Перпендикулярность прямых и плоскостей
Перпендикулярность прямых и плоскостей С днём рождения, Настюша
С днём рождения, Настюша Галилео Галилей
Галилео Галилей Дидактическая игра-паззл Чудовищная загадка или 3 в 1
Дидактическая игра-паззл Чудовищная загадка или 3 в 1 Внезапная сердечная смерть
Внезапная сердечная смерть Презентация Проводы зимы-Масленица
Презентация Проводы зимы-Масленица ИЗГОТОВЛЕНИЕ АВТОРСКОЙ ТЕКСТИЛЬНОЙ КУКЛЫ (на основе пластиковой бутылки)
ИЗГОТОВЛЕНИЕ АВТОРСКОЙ ТЕКСТИЛЬНОЙ КУКЛЫ (на основе пластиковой бутылки) My photo album
My photo album Правонарушение. Юридическая ответственность и её виды
Правонарушение. Юридическая ответственность и её виды Полеты в космос. Оперативное управление космическими аппаратами (лекция 3)
Полеты в космос. Оперативное управление космическими аппаратами (лекция 3) Интернет 2.0. Билайн
Интернет 2.0. Билайн