Слайд 2

«Мы слишком часто даем детям ответы, которые надо выучить, а не
ставим перед ними проблемы, которые надо решить.» Роджер Левин.
Слайд 3

Рассмотрим применение метода на примере урока
«Решение задач на «избыток-недостаток»
Слайд 4

Решение задач
????
Тема урока
Слайд 5

Слайд 6

Изучить
Определить
Научиться
Отработать
ФОРМУЛИРУЕМ ЦЕЛЬ УРОКА
Слайд 7
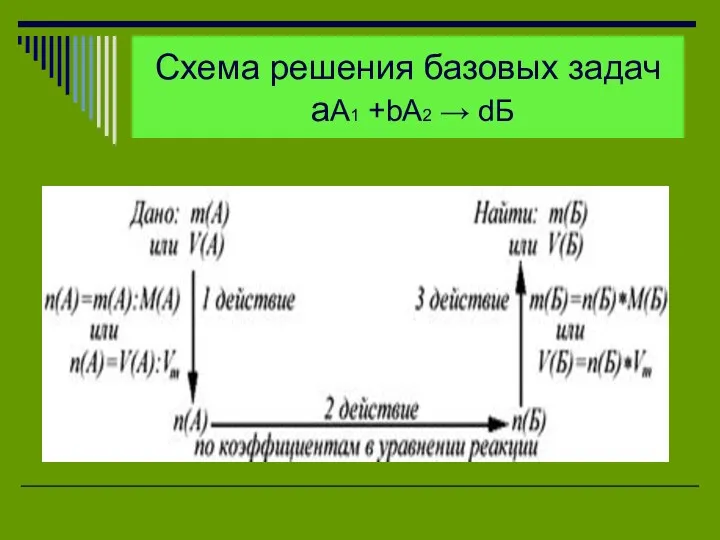
Схема решения базовых задач
aА1 +bА2 → dБ
Слайд 8

Разминка
а) Как определить количество вещества «Б», если известна масса вещества
«А»?
б) Как определить массу вещества «Б», если известно количество вещества «А»?
в) Как определить массу вещества «Б», если известна масса вещества «А»?
г) Как определить объем вещества «Б», если известна масса вещества «А»?
Слайд 9

Тренировочная задача
Вычислите объём углекислого газа (н.у.), который выделится при сгорании 240
г углерода.
Ответ: V (CO2)=
Слайд 10

Вычислите массу продукта реакции Б, полученного при взаимодействии …г вещества
А1 с ...г вещества А2.
Слайд 11
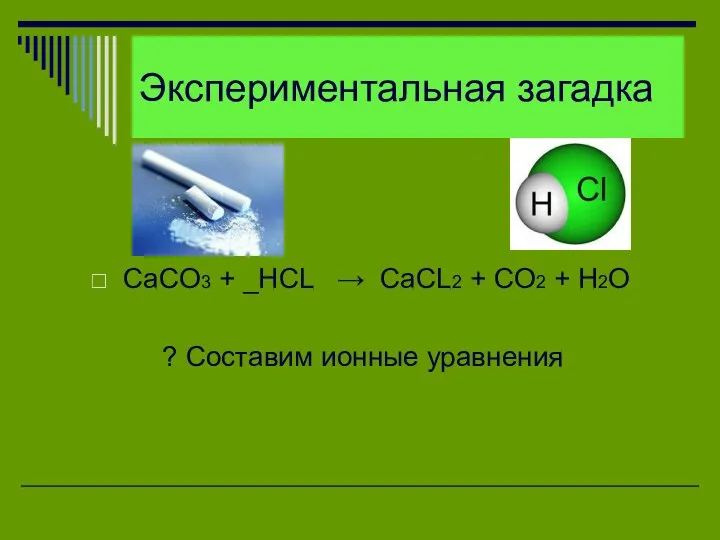
Экспериментальная загадка
CaCO3 + _HCL → CaCL2 + CO2 + H2O
? Составим
ионные уравнения
Слайд 12

Анализируем условие задачи
Дано: m(А1) – исходное вещество (А1)
m(А2) – исходное
вещество (А2)
Найти: m(Б) – продукт реакции (Б)
Слайд 13
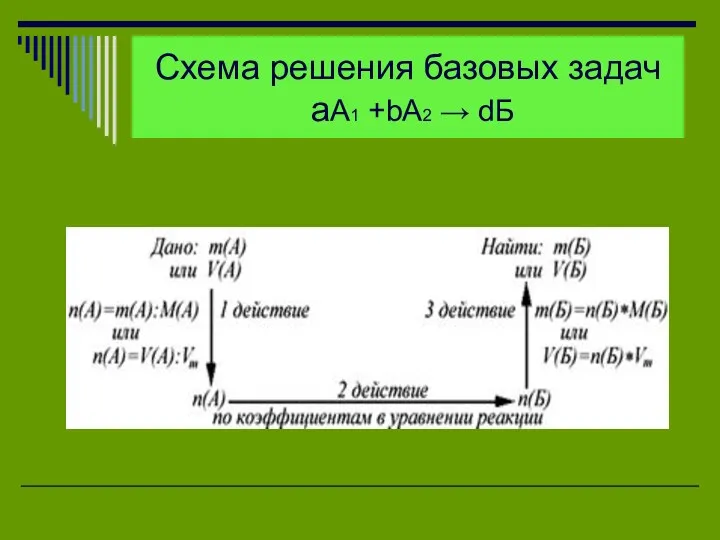
Схема решения базовых задач
аА1 +bА2 → dБ
Слайд 14

?
Количество какого из исходных веществ А1 или А2 нужно использовать
для вычисления количества продукта реакции?
Слайд 15

Химия и кухня
Для приготовления простейших блинов необходимо 1000 мл молока и
500 г муки.
В холодильнике 500 мл молока,
что делать?
Какое из исходных веществ полностью израсходуется для приготовления блинов?
Вывод: расчет ведем по недостаточному количеству одного из продуктов.
Слайд 16

«Решение задач,
на нахождение количества продукта реакции, если одно из веществ дано
«в избытке», а второе
«в недостатке»
Итак, тема нашего урока
Слайд 17

Схема решения задач
данного типа по уравнению реакции
aА1 +bА2 →
dБ
Слайд 18

Алгоритм решения задач
Для реакции aA1 +bA2 = dБ количества вещества А1
и А2 связаны стехиометрическим отношением
n(A1)( по условию) n(A2) (по условию)
a(A1) (по ур.р-ии) b(A2)(по ур.р-ии)
Слайд 19

Если
n(A1) n(A2)
=
a(A1) b(A2)
Вещества А1 и А2 взяты
в стехиометрическом отношении, полностью прореагировали в ходе реакции, расчеты проводим по любому из реагентов
Слайд 20

Если
n(A1) n(A2)
>
a(A1) b(A2)
Вещество А1 взято в избыточном
количестве, оно прореагирует не полностью.
Расчет проводим по веществу А2.
Слайд 21

Закрепление
1. 19,7 г карбоната бария обработали раствором, содержащим 18,9 г азотной
кислоты. Вычислите объем выделившегося газа (н.у.).
2. К раствору, содержащему 77 г силиката калия, прилили раствор, содержащий 102 г нитрата серебра. Какова масса образовавшегося осадка?
Слайд 22

Слайд 23























 Презентация к родительскому собранию на тему Здоровое питание детей
Презентация к родительскому собранию на тему Здоровое питание детей Культура Киевской Руси
Культура Киевской Руси Тенденції та особливості окремих видів захворюваності та травматизму в різних регіонах світу, країнах
Тенденції та особливості окремих видів захворюваності та травматизму в різних регіонах світу, країнах тропинки около школы
тропинки около школы Обобщение знаний по теме Европейская часть России
Обобщение знаний по теме Европейская часть России Разделительно-избирательное травление металлов (РИТМ) при изготовлении печатных плат РИТМ – плата
Разделительно-избирательное травление металлов (РИТМ) при изготовлении печатных плат РИТМ – плата Световые явления в живой и неживой природе
Световые явления в живой и неживой природе Федеральный закон об основах туристской деятельности в Российской Федерации
Федеральный закон об основах туристской деятельности в Российской Федерации Числовые промежутки
Числовые промежутки Изобразительное искусство
Изобразительное искусство Презентация к уроку краеведение. Тема: Редкие животные
Презентация к уроку краеведение. Тема: Редкие животные Артериальная гипер- и гипотензия. Атеросклероз
Артериальная гипер- и гипотензия. Атеросклероз Габдулла Кариев - татар театрының атасы
Габдулла Кариев - татар театрының атасы В мире животных. Математические задачи интересного содержания
В мире животных. Математические задачи интересного содержания Физические процессы, протекающие в околоскважинных зонах
Физические процессы, протекающие в околоскважинных зонах Технология проблемного обучения
Технология проблемного обучения Маркетинг Amway
Маркетинг Amway Рождество Христово
Рождество Христово
 Выпуклость функции. Точки перегиба
Выпуклость функции. Точки перегиба Разработка и реализация образовательного проекта Поезд здоровье
Разработка и реализация образовательного проекта Поезд здоровье Виды арматуры и технические особенности ее установки
Виды арматуры и технические особенности ее установки Экологический аудит обращения с отходами в ОАО Птицефабрика Зеленецкая
Экологический аудит обращения с отходами в ОАО Птицефабрика Зеленецкая Использование ИКТ в совместной музыкальной деятельности с детьми
Использование ИКТ в совместной музыкальной деятельности с детьми Обмін речовин і перетворення енергії
Обмін речовин і перетворення енергії Генерация идей и этапы проектирования
Генерация идей и этапы проектирования Челтерәп аксын чишмәләр
Челтерәп аксын чишмәләр В краю партизанских легенд
В краю партизанских легенд