Содержание
- 2. Задачи урока: Изучить свойства металлов 3 А группы на примере алюминия. Дать характеристику элемента по его
- 3. Al 13 Алюминий (лат. Aluminium) 3 8 2 26,9815 3s2 3p1 Был впервые получен датским физиком
- 4. Характеристика атома алюминия (упр. 1 с. 55) Al – III период, 3 ряд, 3 группа, главная
- 5. Характеристика простого вещества Al
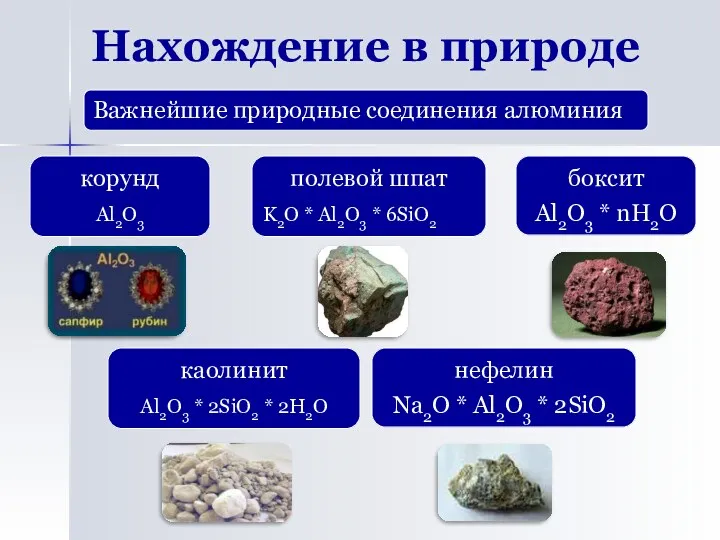
- 6. Нахождение в природе Важнейшие природные соединения алюминия каолинит Al2O3 * 2SiO2 * 2H2O корунд Al2O3 полевой
- 7. Химические свойства простого вещества (упр.3) С простыми веществами: с Br2, I2 – на холоду; с S
- 8. Взаимодействие алюминия с йодом (упр. 6б с. 56) Al + I2 → AlI3
- 9. Взаимодействие алюминия с кислородом (упр. 6а с. 56) Al + O2 → Al2O3
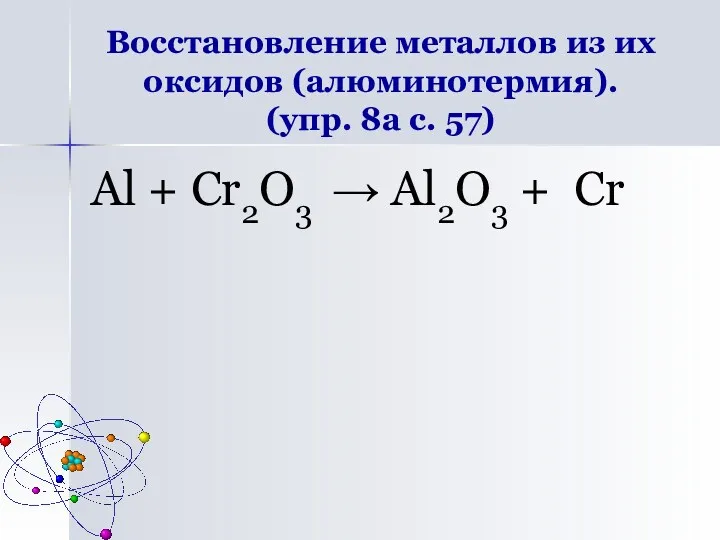
- 10. Восстановление металлов из их оксидов (алюминотермия). (упр. 8а с. 57) Al + Cr2O3 → Al2O3 +
- 11. Взаимодействие алюминия с водой (упр. 9 с. 58) 2Al + 6H2O → 2Al(OH)3 + 3H2 Реакция
- 12. Взаимодействие с растворами кислот (упр. 10(а) с. 58)
- 13. Взаимодействие с раствором гидроксида натрия (упр. 12 с. 59) Al + 2NaOH + 6H2O → 2Na[Al(OH)4
- 14. Реши задачу
- 15. Домашнее задание Учебник: с. 57-60 Упр. в раб. тетради: 6(в, г); 8(б); 10(б) с.57-58 Выполнить презентацию
- 17. Скачать презентацию












 Советы родителям будущих первоклассников.
Советы родителям будущих первоклассников. Танкисты – добровольцы из Тувинской Народной Республики
Танкисты – добровольцы из Тувинской Народной Республики Презентация Пальчиковые игрушки
Презентация Пальчиковые игрушки Где вода-там жизнь
Где вода-там жизнь Основы программирования на языке Python
Основы программирования на языке Python Пристрій керування каналом (Заняття № 7.9)
Пристрій керування каналом (Заняття № 7.9) КузнецовВВ_Презентация
КузнецовВВ_Презентация Игрушки из прищепок. Технология. 2 урок
Игрушки из прищепок. Технология. 2 урок Использование метода проекта в образовательном процессе МБДОУ
Использование метода проекта в образовательном процессе МБДОУ Расписание учебных занятий
Расписание учебных занятий Практика применения законодательства о контрактной системе. Подходы антимонопольного органа и арбитражных судов
Практика применения законодательства о контрактной системе. Подходы антимонопольного органа и арбитражных судов Скоростные поезда
Скоростные поезда Компетентностно-ориентированные задачи по химии для 8 класса
Компетентностно-ориентированные задачи по химии для 8 класса Беларусь в составе Российской империи в конце XVIII - середине XIX вв. (Занятие 7)
Беларусь в составе Российской империи в конце XVIII - середине XIX вв. (Занятие 7) Разработка мероприятий по снижению безработицы в Ставропольском крае
Разработка мероприятий по снижению безработицы в Ставропольском крае Ярмарки в России
Ярмарки в России Презентация к уроку географии на тему Изображение высот и глубин на картах.
Презентация к уроку географии на тему Изображение высот и глубин на картах. Личное и групповое снаряжение
Личное и групповое снаряжение Производство армированных изделий методом намотки
Производство армированных изделий методом намотки Фенилхромановые соединения. Флавоноиды
Фенилхромановые соединения. Флавоноиды Должностные положения бухгалтерского, финансового и экономического отделов
Должностные положения бухгалтерского, финансового и экономического отделов Творческая мастерская. Пасхальный дар
Творческая мастерская. Пасхальный дар Занимательная химия
Занимательная химия Патріотизм
Патріотизм Ниткопись - инновационный игровой метод работы с детьми дошкольного возраста
Ниткопись - инновационный игровой метод работы с детьми дошкольного возраста Страны Евразии. Обобщение. Задания
Страны Евразии. Обобщение. Задания Лабиринты 5-6 классы
Лабиринты 5-6 классы Лирика Пушкина
Лирика Пушкина