Содержание
- 2. Металлы II группы главной подгруппы Цель: Дать общую характеристику металлам II группы (А) главной подгруппы П.С.Х.Э.
- 3. Положение металлов в Периодической системе Изменение свойств в группе История названия Нахождение в природе Физические свойства
- 4. Металлы II группы главной подгруппы Bе бериллий Mg магний Ca кальций Sr стронций Ba барий
- 5. Щелочноземельные металлы: Mg Ca Sr Ba Происхождение этого названия связано с тем, что их гидроксиды являются
- 6. Строение атома Mg +12 2ē, 8ē, 2ē Ca +20 2ē, 8ē, 8 ē, 2ē Sr +38
- 7. Щелочные металлы легкие, мягкие и легкоплавкие, серебристы, стронций имеет золотистый оттенок. Стронций - ковкий Физические свойства
- 8. Физические свойства цвет пламени ρ t плавления 1,74г/см3 651 С0 1,54г/см3 851С0 2,63г/см3 770С0 3,76г/см3 710С0
- 9. ОТКРЫТИЕ МЕТАЛЛОВ Магний и кальций были впервые получены английским химиком и физиком Г. Дэви в 1808
- 10. Магниевая горная порода – магнезит. Нахождение в природе Как активные металлы, они встречаются в природе только
- 11. MgCO3 Карбонат магния - широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для
- 12. В природе: CaCO3 Карбонат кальция – одно из самых распространённых на Земле соединений. Его содержат горные
- 13. CaSO4∙ 2H2O Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат – сульфата кальция. Используется
- 14. MgSO4 Сульфат магния - известный под названием горькая, или английская, соль, используют в медицине в качестве
- 15. Ca3(PO4)2 Фосфат кальция - входит в состав фосфоритов (горная порода) и апатитов (минерал), а также в
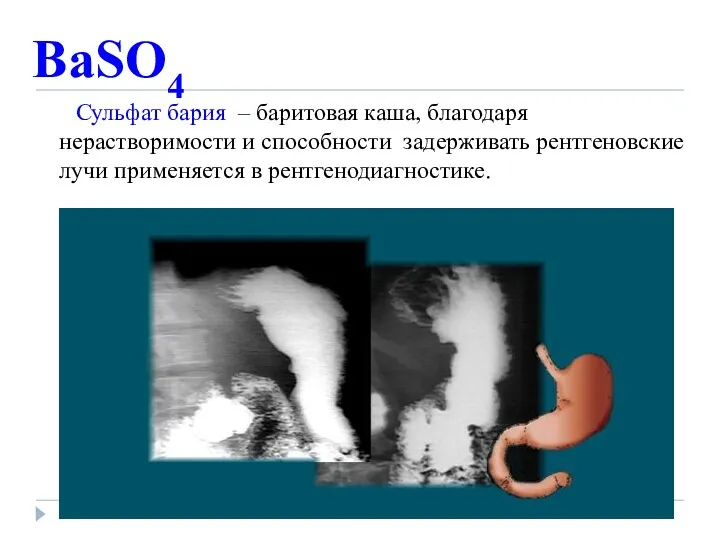
- 16. BaSO4 Сульфат бария – баритовая каша, благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике.
- 17. Са(ОН)2 Гидроксид кальция или гашеная известь называется известковым раствором, образуется при взаимодействии оксида кальция с водой,
- 18. Химические свойства 2Me0 + O02 → 2Me+2O-2 оксид Me0 + H02 → Me+2H2 гидрид Me0 +Cl02
- 19. Особенность бериллия: Бериллий – переходный элемент Бериллий и его соединения проявляют амфотерные свойства, реагируют с кислотами
- 20. Проверка знаний (Самостоятельная работа) Запишите конкретные уравнения реакции, на примере кальция, расставьте коэффициенты методом электронного баланса
- 22. Скачать презентацию


















 История ёлочной игрушки
История ёлочной игрушки Грамматические нормы русского языка. Орфоэпия
Грамматические нормы русского языка. Орфоэпия Saint Valentine
Saint Valentine Криминологическая характеристика преступлений против собственности
Криминологическая характеристика преступлений против собственности Стандарты второго поколения. Технология 5-9 классы
Стандарты второго поколения. Технология 5-9 классы Исполнительно-распорядительный орган муниципального образования
Исполнительно-распорядительный орган муниципального образования Роботы в нашей жизни
Роботы в нашей жизни ПРЕЗЕНТАЦИЯ СЕНСОРНОЕ РАЗВИТИЕ
ПРЕЗЕНТАЦИЯ СЕНСОРНОЕ РАЗВИТИЕ Развитие биологии в додарвинский период
Развитие биологии в додарвинский период Правила дорожные детям знать положено!
Правила дорожные детям знать положено! Проект электрической части ТЭЦ-400 МВт в г. Петрозаводск
Проект электрической части ТЭЦ-400 МВт в г. Петрозаводск Использование пакета прикладных программ Microsoft Office в профессиональной деятельности
Использование пакета прикладных программ Microsoft Office в профессиональной деятельности Крым как туристическая дестинация
Крым как туристическая дестинация Памятники Ижевска
Памятники Ижевска Географические координаты. Градусная сетка. Свойства линий градусной сетки
Географические координаты. Градусная сетка. Свойства линий градусной сетки урок на тему Аммиак
урок на тему Аммиак Викторина по логопедии
Викторина по логопедии О ходе выполнения работ по капитальному ремонту многоквартирных домов в Верхнеуральском МР 16 ноября 2018 года
О ходе выполнения работ по капитальному ремонту многоквартирных домов в Верхнеуральском МР 16 ноября 2018 года Дидактическая игра Зайкины истории
Дидактическая игра Зайкины истории Бронхиальная астма у детей
Бронхиальная астма у детей Артур Шопенгауэр. Немецкий философ
Артур Шопенгауэр. Немецкий философ ВОЛНЫ В ОКЕАНЕ
ВОЛНЫ В ОКЕАНЕ Лист, его строение и значение
Лист, его строение и значение Правила для учеников
Правила для учеников Общий осмотр автомобиля КамАЗ-4310
Общий осмотр автомобиля КамАЗ-4310 Гігієнічні вимоги до водопостачання тваринницьких об’єтів
Гігієнічні вимоги до водопостачання тваринницьких об’єтів Генетическая связь классов соединений
Генетическая связь классов соединений Методист дополнительного образования детей
Методист дополнительного образования детей