Содержание
- 2. Свойства простых веществ Модуль V. Лекция. Металлы VБ подгруппы
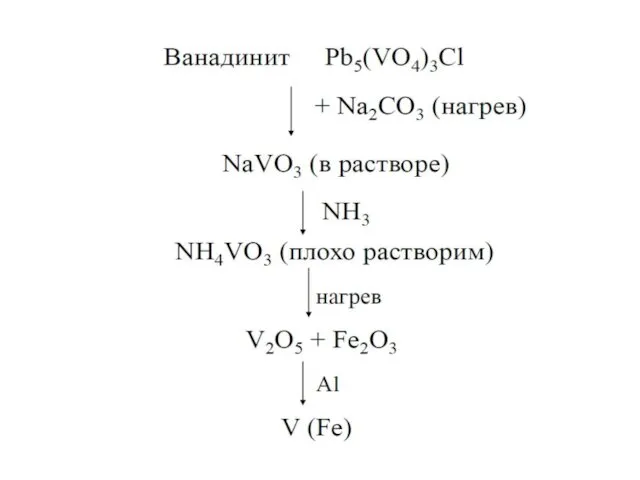
- 4. Природные соединения Модуль V. Лекция. Металлы VБ подгруппы Минерал ванадит 3Pb3(VО4)2 •PbCl2 Содержание V в земной
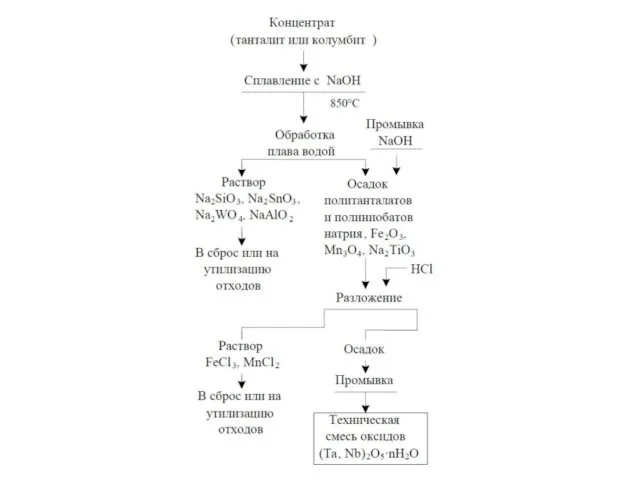
- 6. V2O5 – катализатор окисления SO2 в SO3 Танталовые конденсаторы
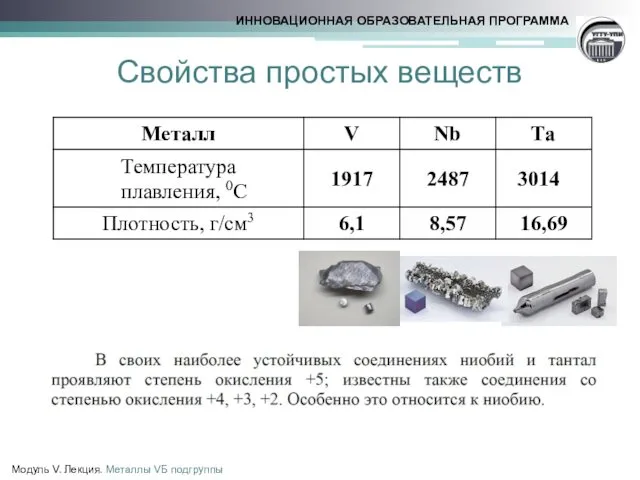
- 10. Свойства простых веществ
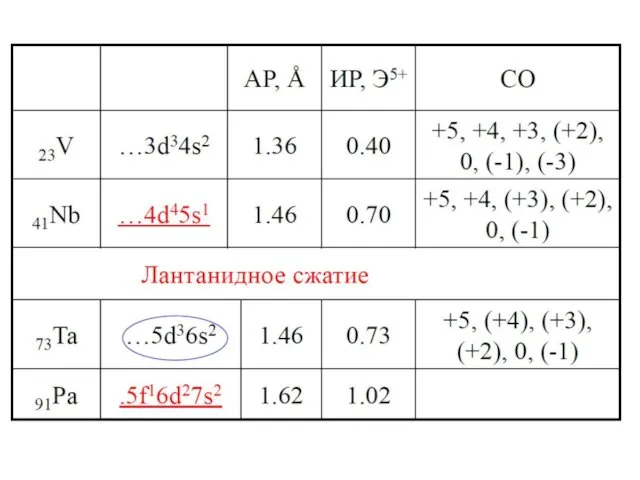
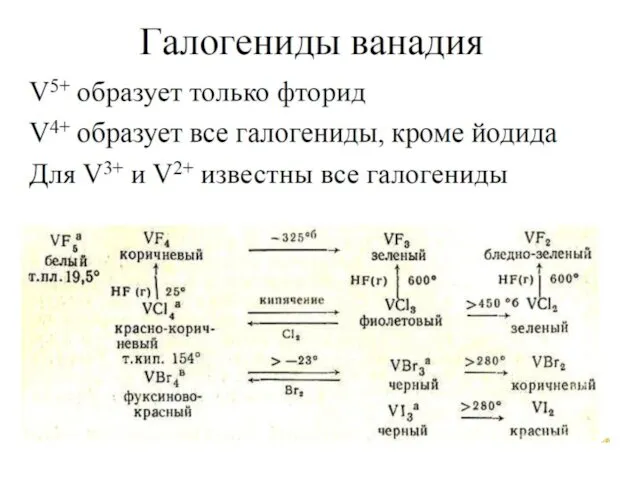
- 11. Свойства простых веществ Модуль V. Лекция. Металлы VБ подгруппы 2V + 12HF = 2H3[VF6] + 3Н2
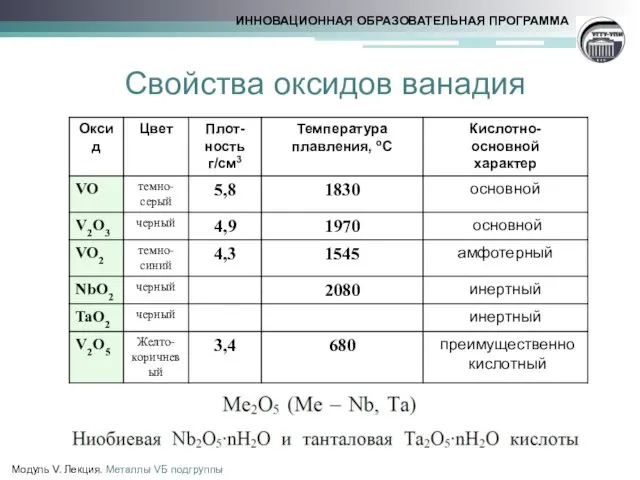
- 12. Cвойства оксидов ванадия Модуль V. Лекция. Металлы VБ подгруппы
- 13. Свойства V2O5
- 14. Свойства VO2 Модуль V. Лекция. Металлы VБ подгруппы 4VO2 + 2NaOH = Na2V4O9 + H2O VO2
- 15. Свойства оксидов металлов(+5) Модуль V. Лекция. Металлы VБ подгруппы Ta2O5 + 6 NaOH = 2 Na3TaO4
- 16. Свойства оксидов металлов (+5)
- 17. Полимеризация ванадатов при рН больше 13 существует ортованадат – VO43– Модуль V. Лекция. Металлы VБ подгруппы
- 18. Полимеризация ванадатов
- 19. Окислительно-воостановительные свойства V(+5) Модуль V. Лекция. Металлы VБ подгруппы
- 20. Окислительно-воостановительные свойства
- 21. Модуль V. Лекция. Металлы VБ подгруппы 2NH4VO3 + Zn + 2H2SO4 = VOSO4 + ZnSO4 +
- 24. Биологическая роль Ванадий и его соединения токсичны. Токсическая доза для человека (70 кг) 0,25 мг, летальная
- 25. Заключение Наиболеее распространенными степенями окисления у V являются +2, +3, +4 и +5. Кислотно–основной характер оксидов
- 27. Скачать презентацию


















 к уроку технологии
к уроку технологии Праздник профессий
Праздник профессий Поделки из природного материала и овощей
Поделки из природного материала и овощей Дополнительные авторские программы художественно - эстетической направленности: ХУДОЖЕСТВЕННЫЙ ЯЗЫК ИЗОБРАЗИТЕЛЬНОГО ИСКУССТВА, СМОТРЮ НА МИР ГЛАЗАМИ ХУДОЖНИКА, ВОЛШЕБНЫЕ СЕКРЕТЫ ХУДОЖНИКА, В МИРЕ ХУДОЖ
Дополнительные авторские программы художественно - эстетической направленности: ХУДОЖЕСТВЕННЫЙ ЯЗЫК ИЗОБРАЗИТЕЛЬНОГО ИСКУССТВА, СМОТРЮ НА МИР ГЛАЗАМИ ХУДОЖНИКА, ВОЛШЕБНЫЕ СЕКРЕТЫ ХУДОЖНИКА, В МИРЕ ХУДОЖ экскурсия на хлебозавод г. Нижний Новгород
экскурсия на хлебозавод г. Нижний Новгород Специальные предложения для хозяйки
Специальные предложения для хозяйки Ленинград - город герой ( презентация)
Ленинград - город герой ( презентация) Страны Восточной Европы
Страны Восточной Европы “ Туган якны өйрәнү” музее.
“ Туган якны өйрәнү” музее. Число π. История длиною в 4000 лет
Число π. История длиною в 4000 лет Этот волшебный Новый Год.
Этот волшебный Новый Год. Компания ALStyle Россия
Компания ALStyle Россия национальный состав населения
национальный состав населения Технологическая цепочка. География чёрной металлургии
Технологическая цепочка. География чёрной металлургии Марк Твен (Сэмюэл Лэнгхорн Клеменс)
Марк Твен (Сэмюэл Лэнгхорн Клеменс) Профилактика и коррекция оптической дисграфии у учащихся начальной школы на уроках русского языка
Профилактика и коррекция оптической дисграфии у учащихся начальной школы на уроках русского языка Формирование художественно-эстетических эталонов при реализации образовательной области Художественное творчество
Формирование художественно-эстетических эталонов при реализации образовательной области Художественное творчество Пересказ рассказа Зоопарк
Пересказ рассказа Зоопарк Электрические аппараты. Коммутационные аппараты. Тема 1.4.3
Электрические аппараты. Коммутационные аппараты. Тема 1.4.3 Гигиена полости рта, ее роль в профилактике стоматологических заболеваний у детей. (Лекция 11)
Гигиена полости рта, ее роль в профилактике стоматологических заболеваний у детей. (Лекция 11) Экоурок Сделаем вместе. Лес - наше богатство. Сохраним его для потомков
Экоурок Сделаем вместе. Лес - наше богатство. Сохраним его для потомков Джек Лондон. Роман Маленькая хозяйка большого дома
Джек Лондон. Роман Маленькая хозяйка большого дома Урок 3. Upd
Урок 3. Upd Страны АСЕАН. Анимированный трафарет
Страны АСЕАН. Анимированный трафарет TYPES_OF_COMPUTERS
TYPES_OF_COMPUTERS Составные элементы ПК TEMPEST (ROXAR)
Составные элементы ПК TEMPEST (ROXAR) Особенности преподавания математики...ТОНК, ч.1
Особенности преподавания математики...ТОНК, ч.1 Planeta_Merkurii_774_-1 (1)
Planeta_Merkurii_774_-1 (1)