Содержание
- 2. Данный урок служит для формирования предметных и метапредметных знаний, умений и навыков у учащихся 9 класса
- 3. Результат урока: сформировать у учащихся знания по теме «Соединения углерода» через активное изучение материала (в форме
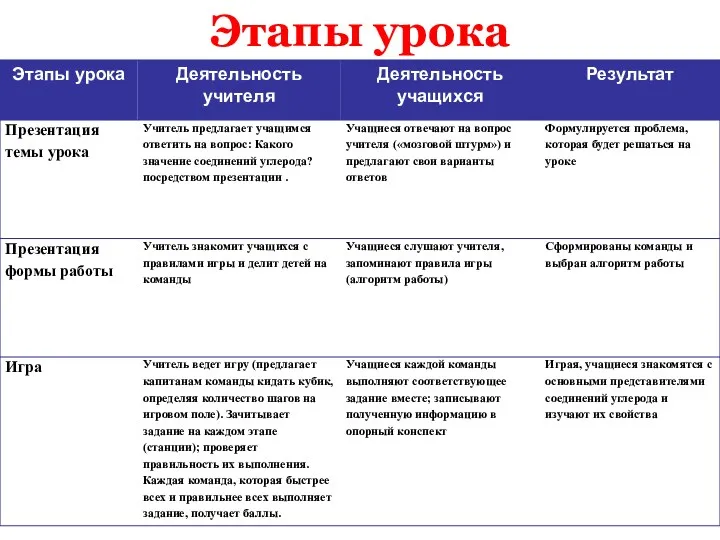
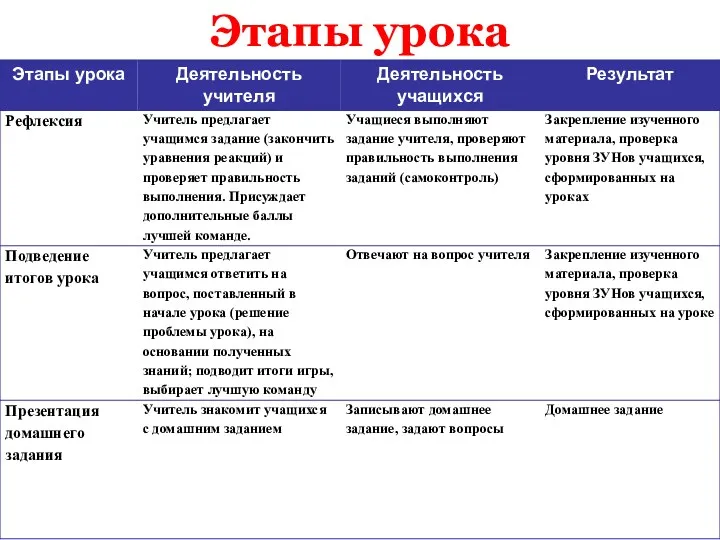
- 4. Этапы урока
- 5. Этапы урока
- 6. СОЕДИНЕНИЯ УГЛЕРОДА: ДРУЗЬЯ или ВРАГИ? учитель химии КНЯЗЕВА Екатерина Александровна школа № 507 Санкт-Петербург
- 7. Na2CO3 техническая сода
- 8. CaCO3 известняк
- 9. CaCO3 мрамор
- 10. (Cu(OH)2)CO3 малахит
- 11. каменный уголь
- 12. нефть
- 13. природный газ
- 20. СОЕДИНЕНИЯ УГЛЕРОДА: ДРУЗЬЯ или ВРАГИ?
- 21. Известно, что оксид серы (IV) при растворении в воде образует неустойчивую сернистую кислоту и как типичный
- 22. SO2 +H2O H2SO3 SO2 +Ca(OH)2 Ca SO3+2H2O CO2 +H2O CO2 +Ca(OH)2
- 23. CO2 +H2O H2CO3 CO2 +Ca(OH)2 CaCO3 + 2H2O CO2 CaCO3
- 24. CO2 CaCO3
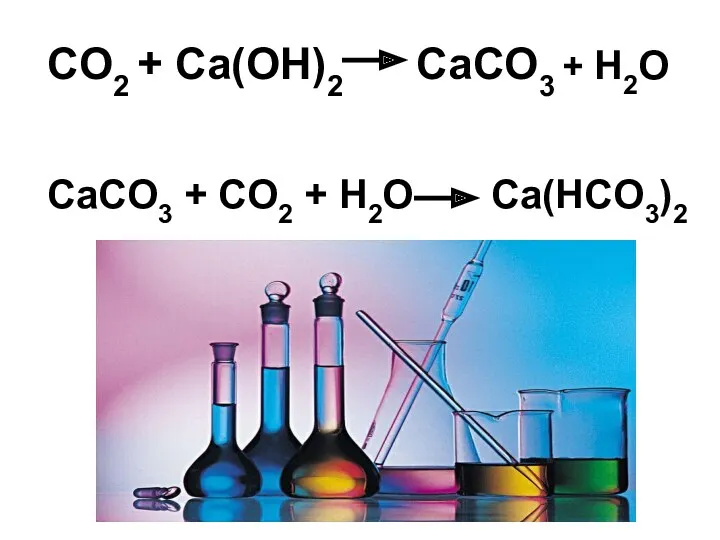
- 25. Что произойдет, если пропустить углекислый газ через раствор гидроксида кальция? Составьте соответствующие уравнения реакций.
- 26. CO2 + Ca(OH)2 CaCO3 + H2O CaCO3 + CO2 + H2O Ca(НCO3)2 +
- 27. Соли угольной кислоты Карбонаты CaCO3 мрамор ГидрокарбонатыNaHCO3 питьевая сода
- 28. Страшная тайна
- 29. Соли угольной кислоты, как и все прочие обладают рядом особых свойств. Одно из них сокрыто в
- 30. Все нерастворимые карбонаты, а также гидрокарбонаты разлагаются при нагревании с образованием углекислого газа: CaCO3 t CO2+
- 31. (NH4)2CO3 CO2 +2NH3+H2O t
- 32. Ca(HCO3)2 t CO2+ CaCO3+ H2O t
- 33. В лаборатории произошло ЧП: от нескольких склянок с реактивами оторвались этикетки. Известно, что в нескольких из
- 34. Карбонаты взаимодействуют с кислотами (качественная реакция на карбонат-ион): СaCO3 +2HCl CaCl2 + H2O+CO2
- 35. NaHCO3 +CH3COOH CH3COONa+CO2+H2O
- 36. СaCO3 +2HCl CaCl2 + H2O+CO2
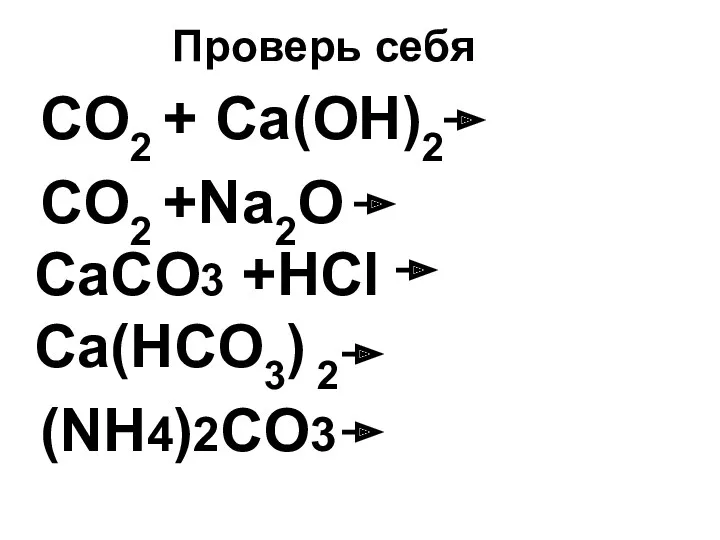
- 37. Проверь себя CO2 + Ca(OH)2 CO2 +Na2O СaCO3 +HCl Ca(HCO3) 2 (NH4)2CO3
- 38. CO2 + Ca(OH)2 СaCO3 + H2O CO2 +Na2O Na2CO3 СaCO3 +2HCL CaCl2+H2O+CO2 Ca(HCO3)2 t CO2+ CaCO3
- 40. Скачать презентацию

















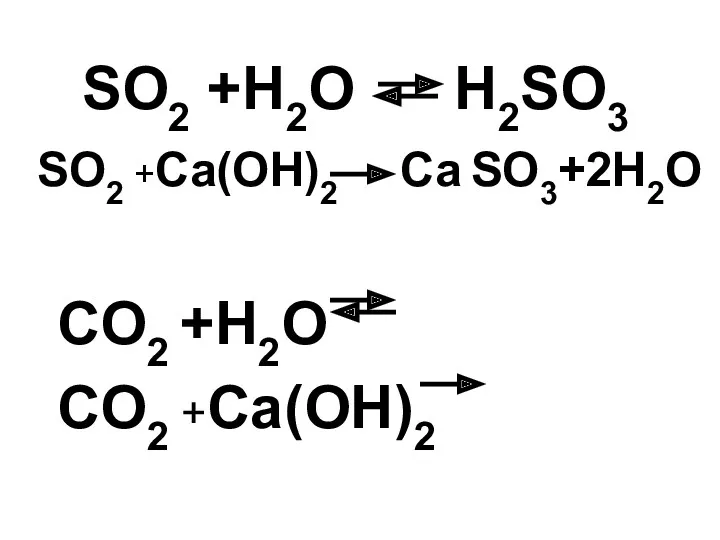
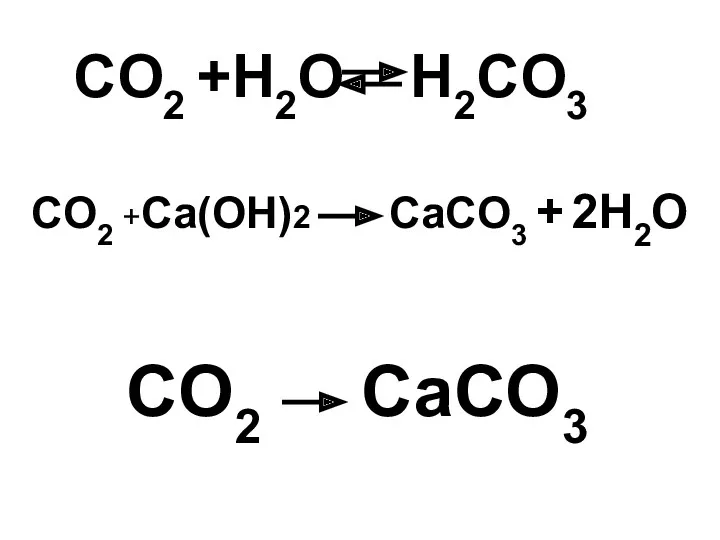







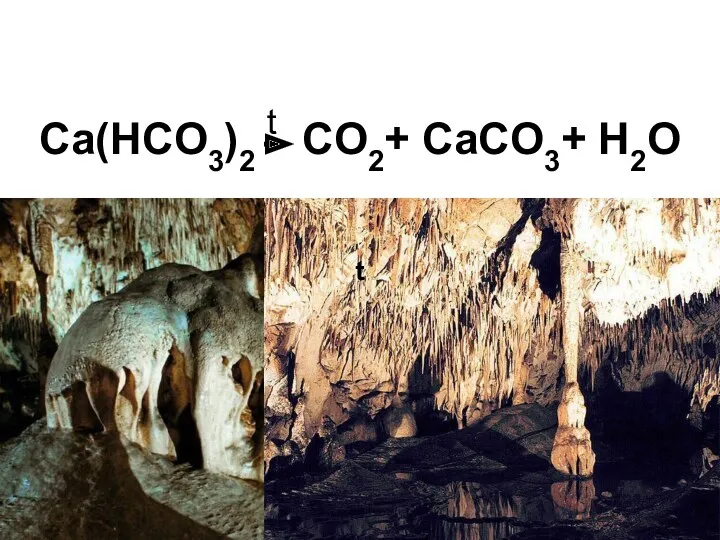




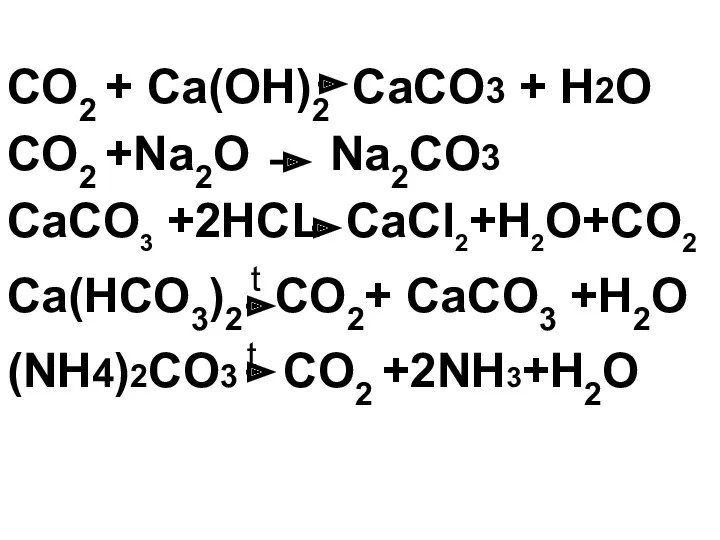
 Цифровые технологии печати
Цифровые технологии печати Ортодонтиядағы инновациялық технологиялар
Ортодонтиядағы инновациялық технологиялар Презентация Методы обучения в современной школе
Презентация Методы обучения в современной школе фотоотчёт открытого занятия
фотоотчёт открытого занятия Модальные глаголы
Модальные глаголы Общие закономерности эволюции. Филогенез дыхательной и кровеносной систем человека
Общие закономерности эволюции. Филогенез дыхательной и кровеносной систем человека Свойства степени с натуральными показателями. Урок 54
Свойства степени с натуральными показателями. Урок 54 проект по благоустройству площадки средней группы МКДОУ Детский сад совхоза Вторая пятилетка
проект по благоустройству площадки средней группы МКДОУ Детский сад совхоза Вторая пятилетка Гетероскедостичность и ее последствия
Гетероскедостичность и ее последствия ЕГЭ по истории. (Задание 8)
ЕГЭ по истории. (Задание 8) Конспект урока и презентация к уроку географии Западная и Центральная Африка. Нигерия.
Конспект урока и презентация к уроку географии Западная и Центральная Африка. Нигерия. Техногенні екологічні катастрофи
Техногенні екологічні катастрофи Мой город
Мой город Управление человеческими ресурсами
Управление человеческими ресурсами Что такое дисграфия?
Что такое дисграфия? Константин Дмитриевич Ушинский
Константин Дмитриевич Ушинский Artificial Intelligence
Artificial Intelligence Мое электронное портфолио
Мое электронное портфолио Протоколы и методы обработки сообщений
Протоколы и методы обработки сообщений Собственная методическая разработка Непосредственная образовательная деятельность с детьми подготовительного возраста в условиях ФГОС
Собственная методическая разработка Непосредственная образовательная деятельность с детьми подготовительного возраста в условиях ФГОС Силовые трансформаторы
Силовые трансформаторы Западная Европа в ХI-ХIII веках. Инквизиция и крестовые походы
Западная Европа в ХI-ХIII веках. Инквизиция и крестовые походы Zeitschriften Deutschlands
Zeitschriften Deutschlands Museo del Prado
Museo del Prado Зерномучные товары. Мука
Зерномучные товары. Мука Сложение и вычитание дробей с разными знаменателями. Смешанные числа
Сложение и вычитание дробей с разными знаменателями. Смешанные числа Презентация к уроку по теме Численность и воспроизводство населения мира
Презентация к уроку по теме Численность и воспроизводство населения мира Проект Умный Дом
Проект Умный Дом