Содержание
- 2. Цели урока. Закрепить полученные знания об одноатомных спиртах. Сформировать представления о многоатомных спиртах. Найти в общем
- 3. Вопросы для повторения Какие соединения называются одноатомными предельными спиртами? Приведите примеры. Какими способами могут быть получены
- 4. Вопросы для повторения Где применяют метиловый и этиловый спирты? Какое физиологическое действие оказывает этанол на организм
- 5. Многоатомными спиртами называют производные предельных углеводородов, в молекулах которых два или несколько атомов водорода замещены на
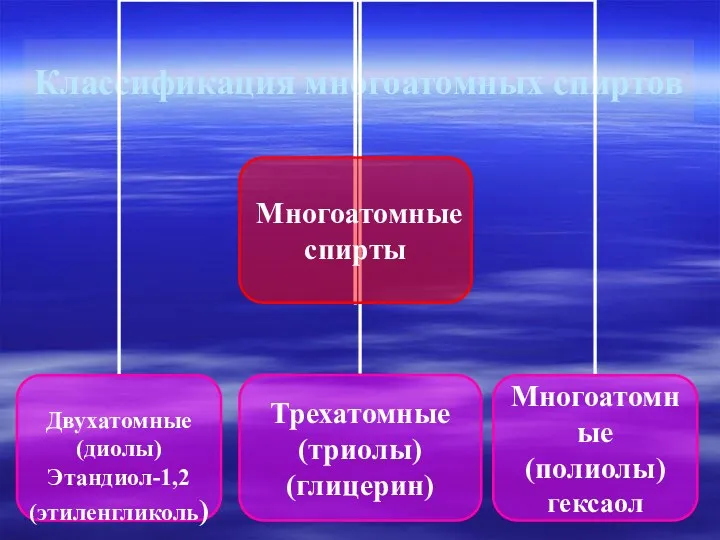
- 6. Классификация многоатомных спиртов
- 7. Структурные формулы Этандиол-1,2 (этиленгликоль) Пропантриол-1,2,3 (глицерин) СН2 – СН2 ОН ОН
- 8. Бесцветная, прозрачная, вязкая, сиропообразная жидкость, сладкая на вкус. не ядовит t кип= 2900 С Неограниченно растворим
- 9. Физические свойства этиленгликоля Бесцветная вязкая жидкость со своеобразным запахом, сладкого вкуса, ядовит. t кип = 1980
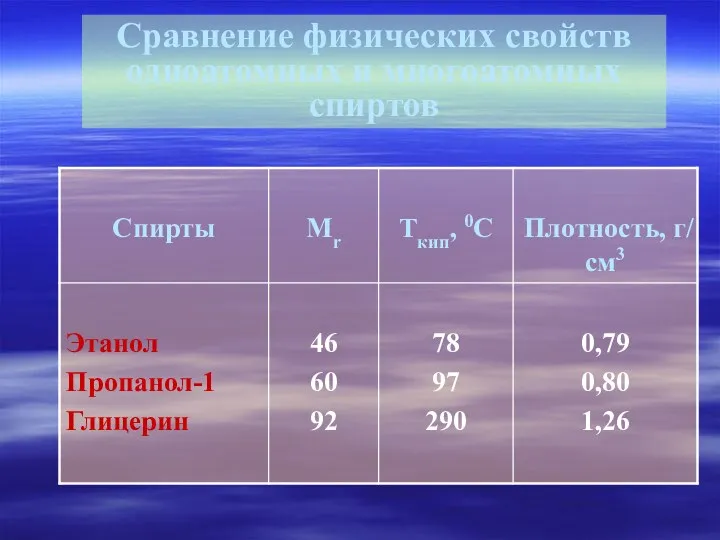
- 10. Сравнение физических свойств одноатомных и многоатомных спиртов
- 11. Получение 3CH2=CH2 + 2KMnO4 + 4H2O → 3HO–CH2–CH2–OH + 2MnO2 + 2KOH Этиленгликоль (этандиол-1,2) синтезируют из
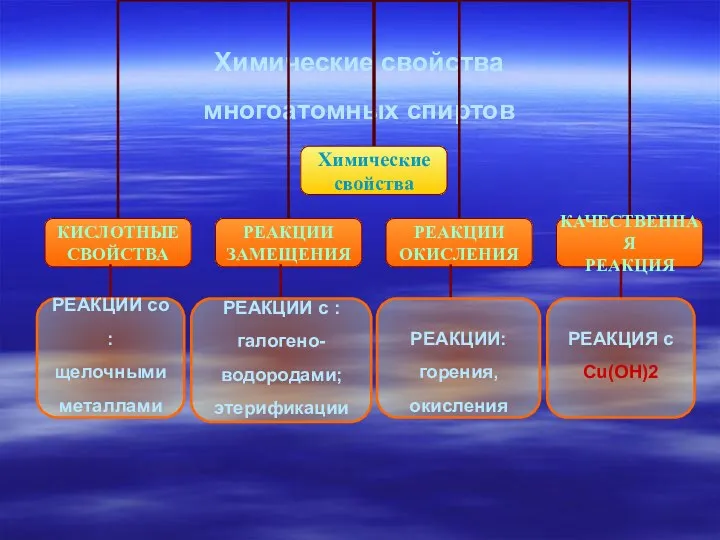
- 12. Химические свойства многоатомных спиртов РЕАКЦИИ со : щелочными металлами РЕАКЦИИ с : галогено- водородами; этерификации РЕАКЦИИ:
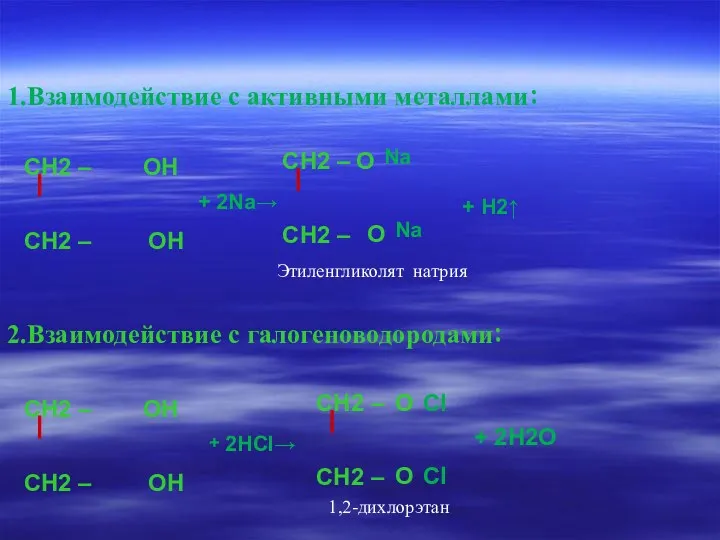
- 13. 1.Взаимодействие с активными металлами: Na Na Этиленгликолят натрия 2.Взаимодействие с галогеноводородами: 1,2-дихлорэтан + 2Na→ + H2↑
- 14. СН – ОН СН2 – СН2 – ОН ОН СН – О СН2– СН2– О О
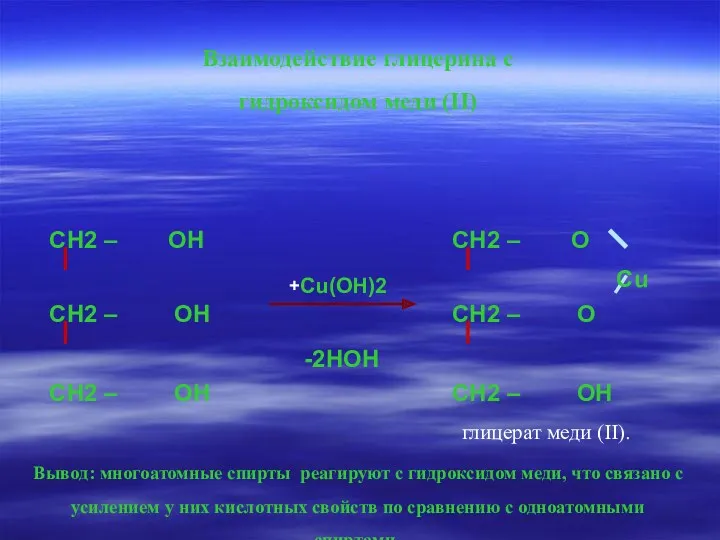
- 15. Взаимодействие глицерина с гидроксидом меди (II) Вывод: многоатомные спирты реагируют с гидроксидом меди, что связано с
- 16. Лабораторный опыт К свежеприготовленному осадку гидроксида меди приливаем раствор глицерина. Осадок гидроксида меди растворяется и образуется
- 17. Применение этиленгликоля Антифризы – незамерзающие жидкости Пластиковые бутылки Синтетическое волокно лавсан
- 18. Применение глицерина Крема Кондитерские изделия Изделия из кожи Нитроглицерин Пластмассовые изделия Мыло
- 19. Ксилит – пятиатомный спирт
- 20. Н. Н. Зинин Альфред Нобель
- 21. Выводы Во всех многоатомных спиртах гидроксильные группы находятся при разных атомах углерода; число гидроксогрупп влияет на
- 23. Скачать презентацию















 Техника обработки бумаги и картона
Техника обработки бумаги и картона Церковь после Смуты
Церковь после Смуты Ключевые отличительные особенности товарной линейки. Холодильники LG
Ключевые отличительные особенности товарной линейки. Холодильники LG Ресей федерациясы: ауыл шаруашылығы
Ресей федерациясы: ауыл шаруашылығы Резонанс в линейных электрических цепях
Резонанс в линейных электрических цепях Каменный уголь
Каменный уголь Основы устройства. Классификация космических аппаратов. (Лекция 1)
Основы устройства. Классификация космических аппаратов. (Лекция 1) Экономика и экология
Экономика и экология Аудио система в автомобиле
Аудио система в автомобиле Project Expert. Описание программы
Project Expert. Описание программы Праведник народов мира Кецко Антон Митрофанович, пресвитер Минской церкви ЕХБ с января 1942 по июнь 1944
Праведник народов мира Кецко Антон Митрофанович, пресвитер Минской церкви ЕХБ с января 1942 по июнь 1944 МАОУ Шеманихинская СОШ краеведческий музей. Экспозиция Боевой славы
МАОУ Шеманихинская СОШ краеведческий музей. Экспозиция Боевой славы Михайловский дворец. Русский музей. 10 класс
Михайловский дворец. Русский музей. 10 класс Классификация аннтиагрегантов, показания и противопоказания к назначению антиагрегантов, побочные эффекты
Классификация аннтиагрегантов, показания и противопоказания к назначению антиагрегантов, побочные эффекты Презентация: Организация предметно-пространственной среды в соответствии с ФГОС ДО.
Презентация: Организация предметно-пространственной среды в соответствии с ФГОС ДО. Инновации в системе дополнительного образования.
Инновации в системе дополнительного образования. Дөңгелек ауыздылар мен сүйекті балықтар кластарының систематикалық топтарын анықтаудын әдістері
Дөңгелек ауыздылар мен сүйекті балықтар кластарының систематикалық топтарын анықтаудын әдістері Правописание глаголов
Правописание глаголов Программа дополнительного образования Весёлые ладошки, для детей раннего и младшего дошкольного возраста
Программа дополнительного образования Весёлые ладошки, для детей раннего и младшего дошкольного возраста Реле тока обратной последовательности РТФ-1М. Лекции 22
Реле тока обратной последовательности РТФ-1М. Лекции 22 Конструкции юбок. Мерки, необходимые для построения чертежа основы юбки
Конструкции юбок. Мерки, необходимые для построения чертежа основы юбки Великие географические открытия
Великие географические открытия Межотраслевые комплексы. Чёрная и цветная металлургия России
Межотраслевые комплексы. Чёрная и цветная металлургия России Особенности инфекционного контроля и инфекционной безопасности в кожно-венерологических ЛПО
Особенности инфекционного контроля и инфекционной безопасности в кожно-венерологических ЛПО День Героев Отчества
День Героев Отчества Загадки земли. Удивительные грани
Загадки земли. Удивительные грани Экспериментальная психология. Влияние экспериментатора и испытуемых на результаты эксперимента. (Лекция 5)
Экспериментальная психология. Влияние экспериментатора и испытуемых на результаты эксперимента. (Лекция 5) Радиоэлектронная аппаратура
Радиоэлектронная аппаратура