Содержание
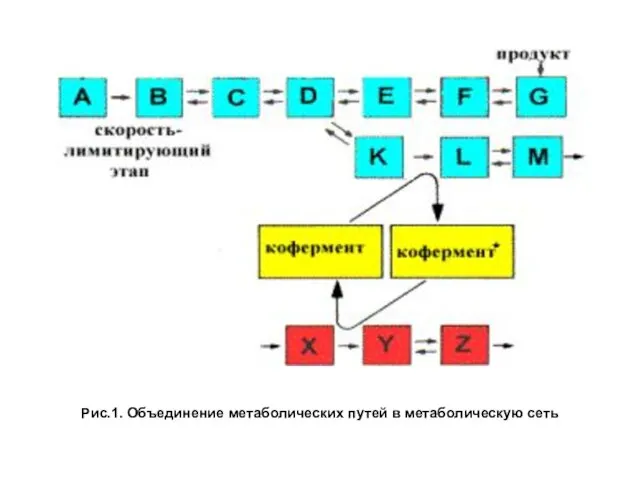
- 2. Метаболизм представляет собой совокупность всех химических реакций, происходящих в организме. Под термином метаболический путь подразумевается последовательность
- 3. Рис.1. Объединение метаболических путей в метаболическую сеть
- 4. Анаболизм и катаболизм. В метаболизме можно выделить пути анаболизма, которые предназначены для биосинтезов, и пути катаболизма,
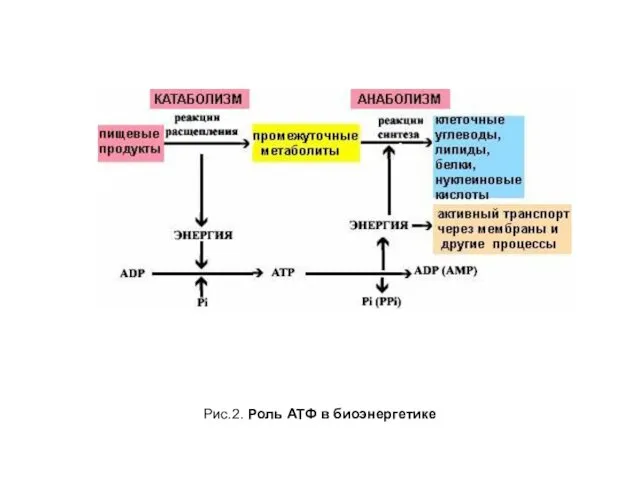
- 5. Роль АТФ Процессы, протекающие с потреблением и выделением энергии, связаны между собой. Центральную роль в этой
- 6. Рис.2. Роль АТФ в биоэнергетике
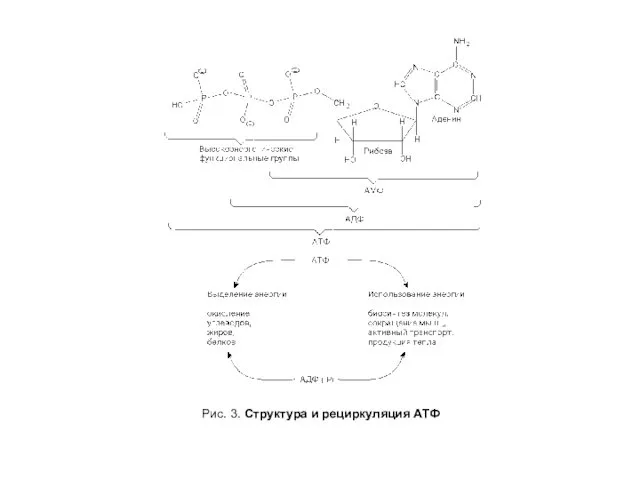
- 7. Рис. 3. Структура и рециркуляция АТФ
- 8. Регуляция метаболизма. Общие аспекты Среди многих ферментов, обеспечивающих протекание того или иного метаболического пути со скоростью,
- 9. Аллостерическая регуляция ключевых ферментов позволяет получить немедленный ответ клетки на изменения условий среды, выражающиеся в изменении
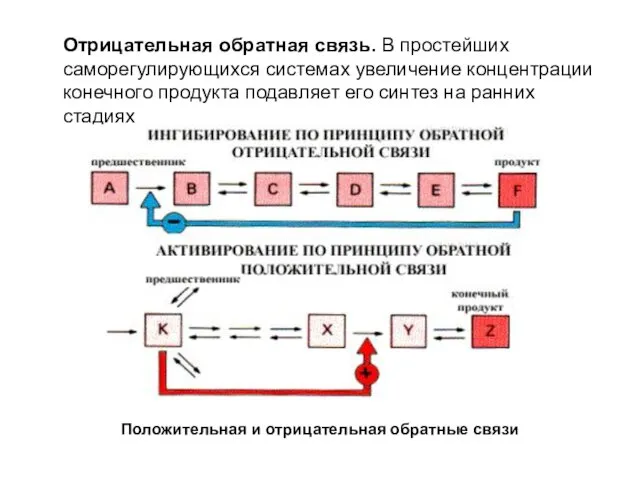
- 10. Отрицательная обратная связь. В простейших саморегулирующихся системах увеличение концентрации конечного продукта подавляет его синтез на ранних
- 11. Положительная обратная связь наблюдается, когда метаболит-предшественник активирует стадию, контролирующую его дальнейшее превращение, например, переход в запасные
- 12. Индукция или репрессия синтеза ферментов приводит к изменению количества ферментов и, значит, скорости метаболизма. Подобным способом
- 13. Механизм действия гормонов на метаболизм Гормоны — это межклеточные химические посредники (мессенджеры). Они секретируются одним типом
- 14. Гормоны обладают высокой биологической активностью. Их действие проявляется при очень низких концентрациях (10-6 – 10-10 моль/л).
- 15. Система вторичных посредников. Появление в клетке вторичного посредника является пусковым моментом для изменения метаболизма, осуществляемого обычно
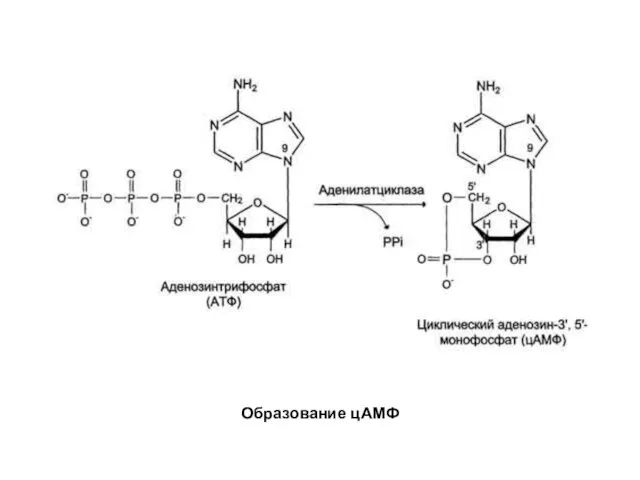
- 16. Образование цАМФ
- 17. Функционирование системы трансмембранной передачи сигналов обеспечивают белки: Rs — рецептор сигнальной молекулы, которая активирует аденилатциклазу, Ri
- 18. взаимодействие α-субъединицы с аденилатциклазой приводит к изменению конформации фермента и его активации, увеличивается скорость образования цАМФ
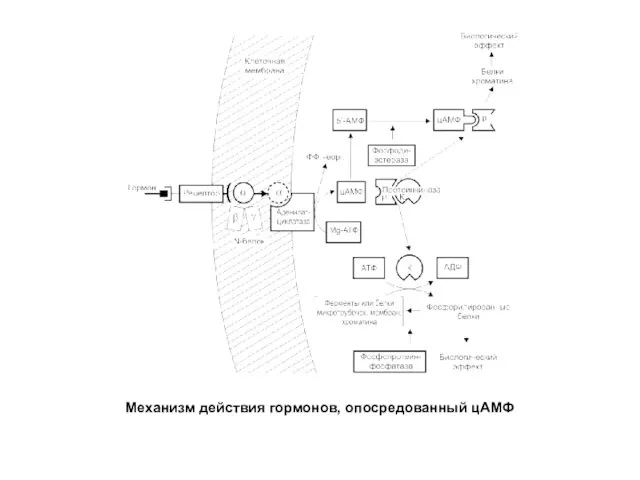
- 19. Механизм действия гормонов, опосредованный цАМФ
- 20. Активация протеинкиназы А (ПКА) Молекулы цАМФ могут обратимо соединяться с регуляторными субъединицами ПКА. Присоединение цАМФ к
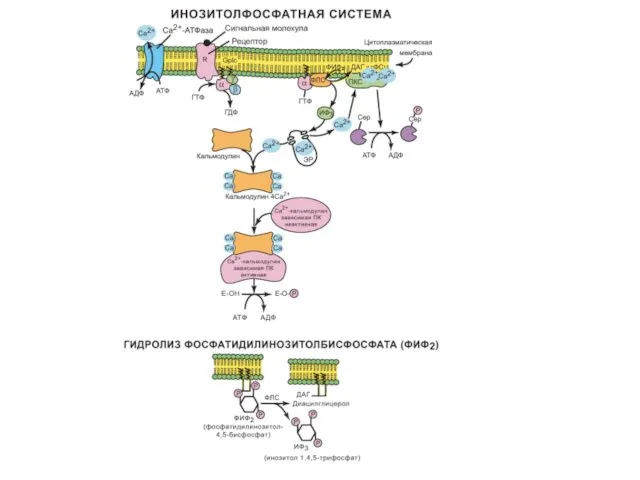
- 21. Инозитолфосфатная система Инозитолфосфатная система включает 3 основных мембранных белка: R (рецептор), фосфолипазу С и Gplc —
- 22. Инозитолфосфатная система Это вызывает диссоциацию комплекса; α-GTPвзаимодействует с фосфолипазой С и активирует ее. Субстратом этого фермента
- 23. Инозитолфосфатная система Повышение концентрации Са2+ в цитозоле клетки увеличивает скорость взаимодействия Са2+ с неактивным цитозольным ферментом
- 24. Инозитолфосфатная система Для снижения концентрации Са2+ в клетке до исходного уровня работают системы Са2+-АТФаз и транслоказ
- 25. Инозитолфосфатная система Активность транслоказ Са2+ и Са2+-АТФ-аз может регулироваться: комплексом [кальмодулин][4Са2+]; ПКА (фосфорилированием); ПКС (фосфорилированием), а
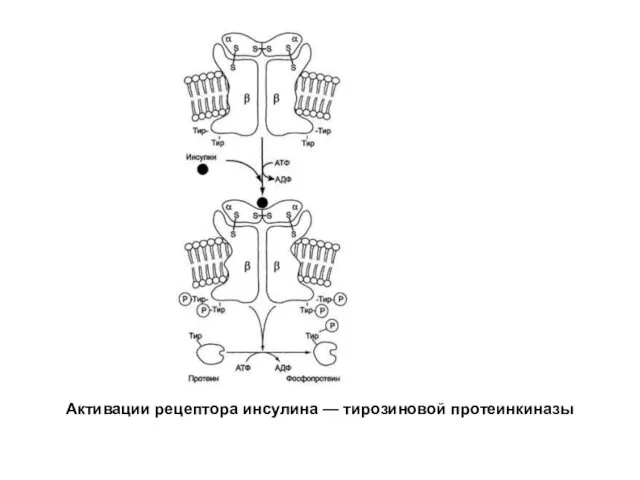
- 27. Трансдукция сигнала через инсулиновый рецептор Рецептор инсулина представляет собой тирозиновую протеинкиназу (ТП), то есть протеинкиназу, фосфорилируюшую
- 28. Активации рецептора инсулина — тирозиновой протеинкиназы
- 29. Трансдукция сигнала через инсулиновый рецептор Каталитический центр ТП находится на внутриклеточных доменах β-субъединиц. Присоединение инсулина к
- 31. Скачать презентацию




















 Правовые и организационные основы проведения судебных экспертиз (общие и ведомственные)
Правовые и организационные основы проведения судебных экспертиз (общие и ведомственные) Патриотическое воспитание дошкольников
Патриотическое воспитание дошкольников Моделирование лучистого теплообмена
Моделирование лучистого теплообмена Путешествие в сказочную страну сказок и книг для учащихся 1-3классов Диск
Путешествие в сказочную страну сказок и книг для учащихся 1-3классов Диск Принтеры. Принцип действия
Принтеры. Принцип действия Действия с обыкновенными дробями 5 класс
Действия с обыкновенными дробями 5 класс Растительный и животный мир России.
Растительный и животный мир России. Механизм дыхания
Механизм дыхания ВИЧ-инфекция. Группы риска
ВИЧ-инфекция. Группы риска Трансформация токов в трансформаторе при коротком замыкании
Трансформация токов в трансформаторе при коротком замыкании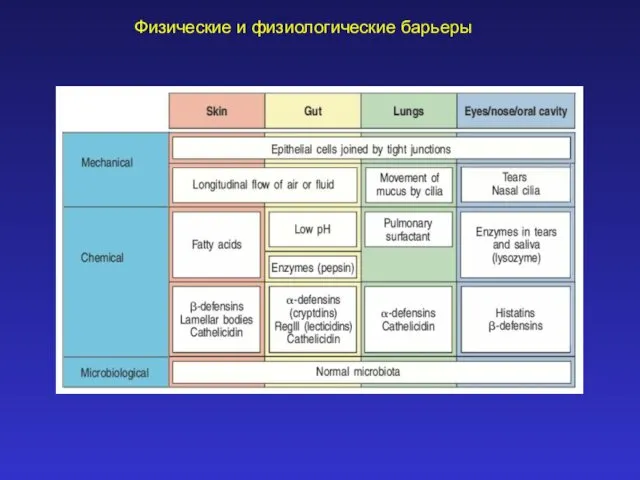 Физические и физиологические барьеры (иммунология, лекция 2)
Физические и физиологические барьеры (иммунология, лекция 2) Техническое обслуживание и ремонт передней подвески автомобиля Skoda Octavia
Техническое обслуживание и ремонт передней подвески автомобиля Skoda Octavia Устойчивые выражения
Устойчивые выражения Коррекция общей моторики у детей со стертой формой дизартрии.
Коррекция общей моторики у детей со стертой формой дизартрии. Весенние цветы. Урок технологии 3 класс
Весенние цветы. Урок технологии 3 класс Щелочноземельные металлы
Щелочноземельные металлы Образы русской природы. С.Я. Маршак Гроза днём, В лесу над росистой поляной
Образы русской природы. С.Я. Маршак Гроза днём, В лесу над росистой поляной Выступление начальника отдела организации выявления нарушений валютного законодательства
Выступление начальника отдела организации выявления нарушений валютного законодательства Развитие лексико - грамматического строя речи для детей (4 - 7 лет) презентация. Тема: Дикие животные наших лесов
Развитие лексико - грамматического строя речи для детей (4 - 7 лет) презентация. Тема: Дикие животные наших лесов Обустройство нефтяных месторождений
Обустройство нефтяных месторождений Масленица
Масленица Мероприятия 10 класс
Мероприятия 10 класс Строение органов дыхания животных
Строение органов дыхания животных Architecture in Uniform
Architecture in Uniform Лечебная физкультура при спастических и вялых параличах. Атаксия
Лечебная физкультура при спастических и вялых параличах. Атаксия Визуализация чистовой отделки 55 квадратных метров (с мебелью)
Визуализация чистовой отделки 55 квадратных метров (с мебелью) День открытых дверей в ТОГБПОУ Тамбовский областной медицинский колледж
День открытых дверей в ТОГБПОУ Тамбовский областной медицинский колледж Формы организации обучения. Урок, структура урока, требования к уроку
Формы организации обучения. Урок, структура урока, требования к уроку