Содержание
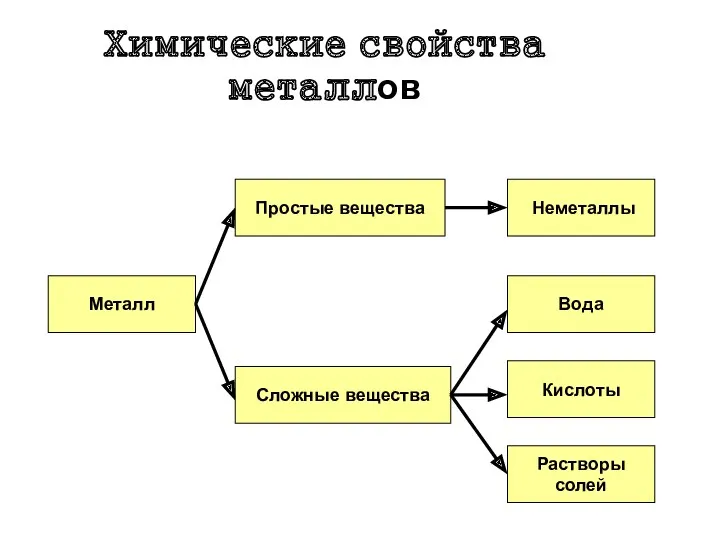
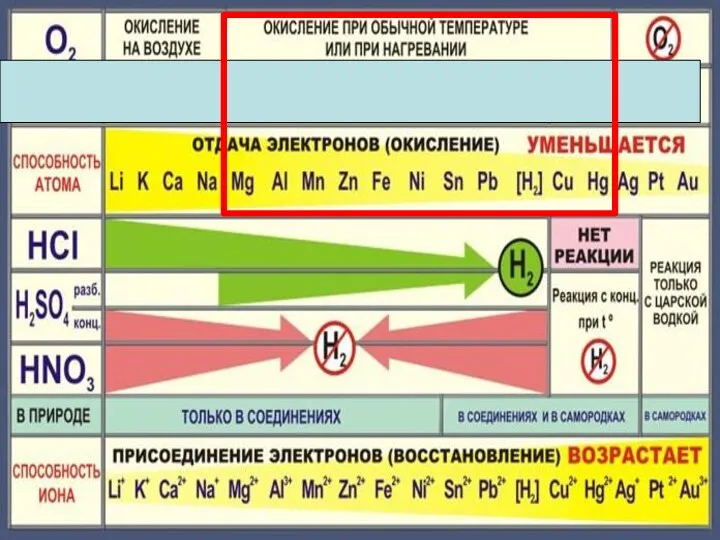
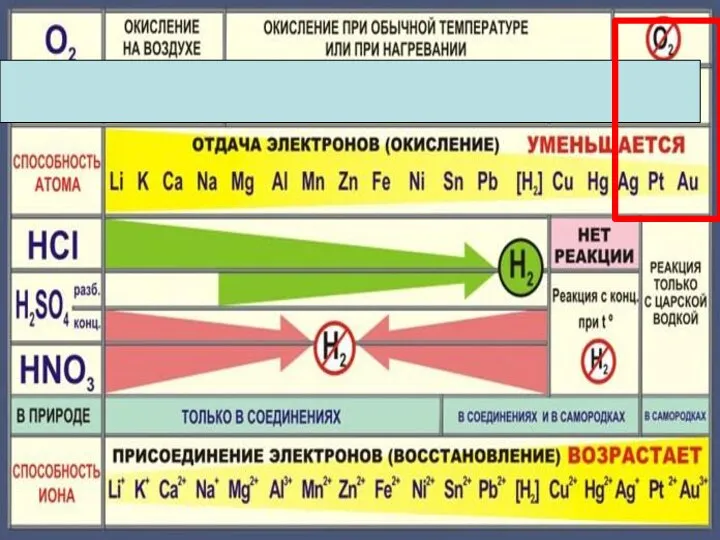
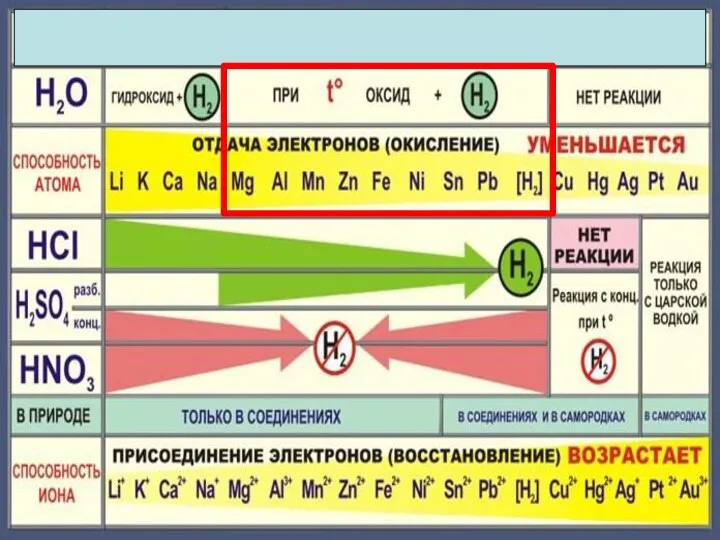
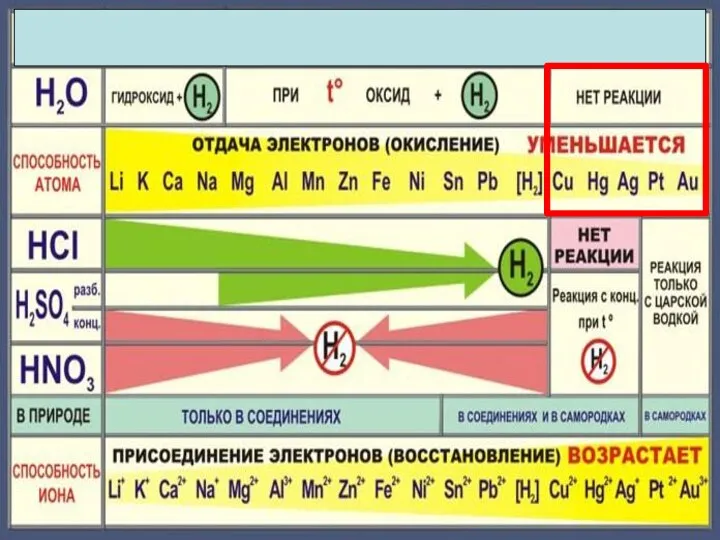
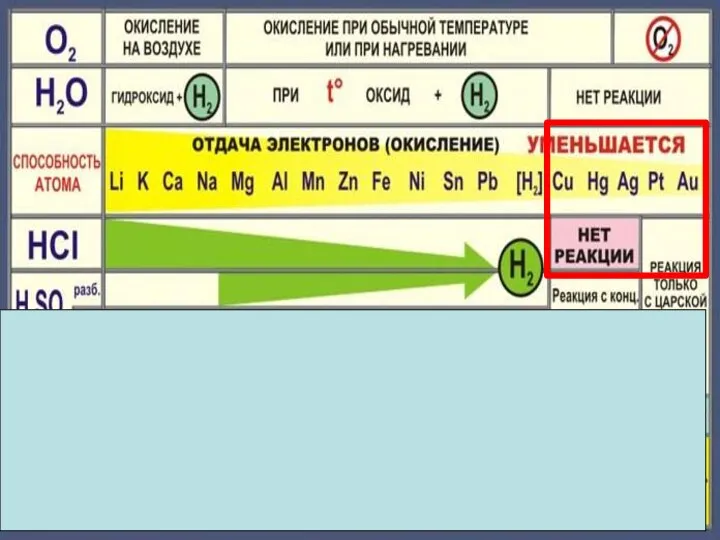
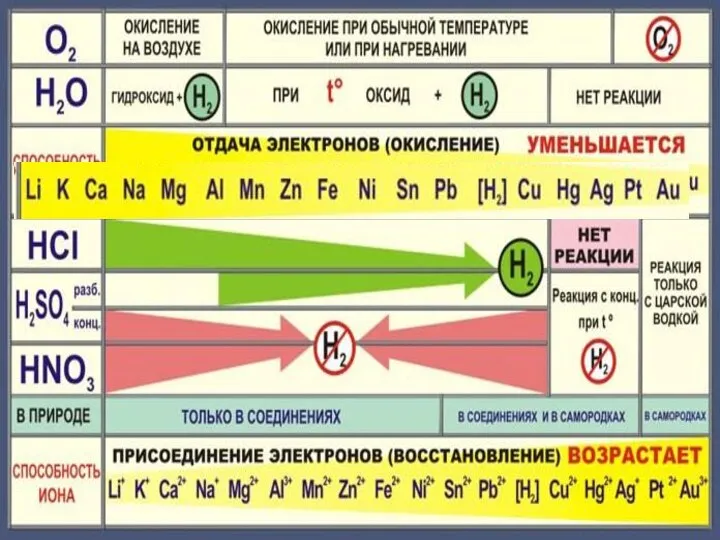
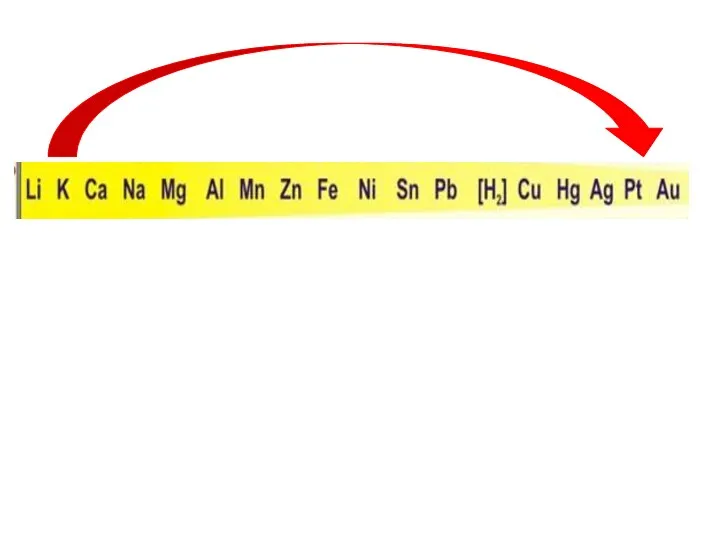
- 5. Химические свойства металлов Металл Простые вещества Сложные вещества Неметаллы Вода Кислоты Растворы солей
- 6. Cu + Cl2 =CuCl2 2Mg + CO2 = 2MgO + C С неметаллами С кислотными оксидами
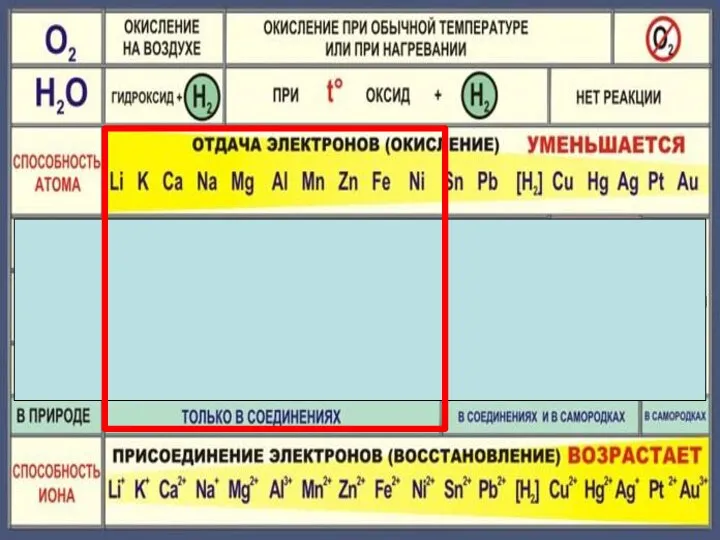
- 10. 4Na + O2 = 2Na2O 2Mg + O2 = 2MgO при нагревании 4Ag + O2 =
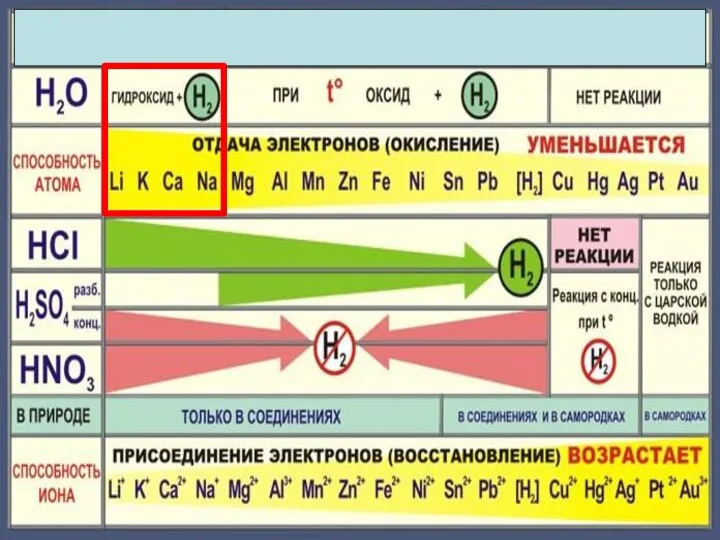
- 12. 2Na + 2H2O 2NaOH +H2 2K + 2H2O = 2KOH + H2
- 14. 3Fe + 4H2O = Fe3O4+4 H2
- 16. Cu + H2О = реакция не идет
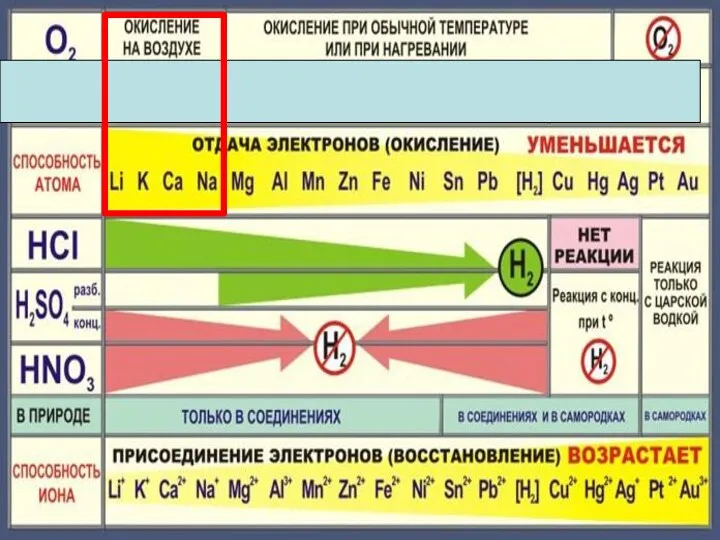
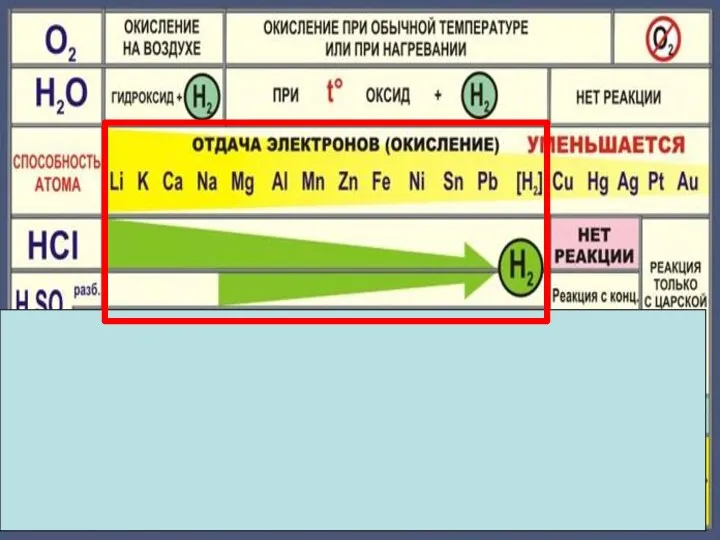
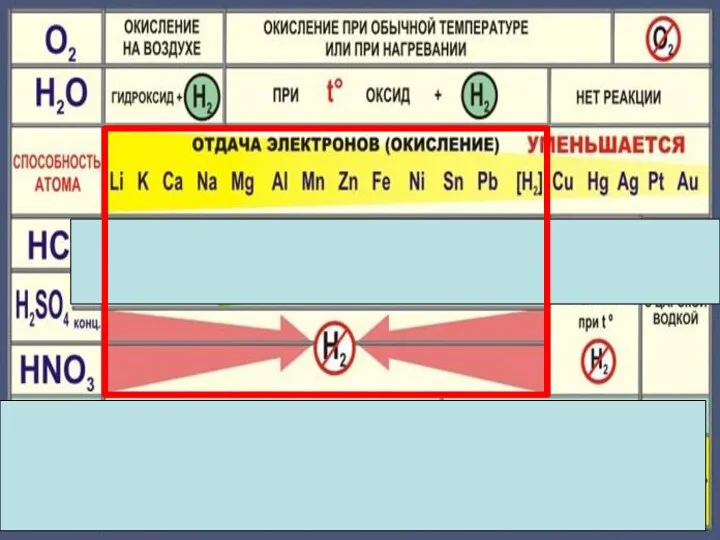
- 18. Zn + 2HCl = ZnCl2 + H2 Fe + 2HCl = FeCl2 + H2 Cu +
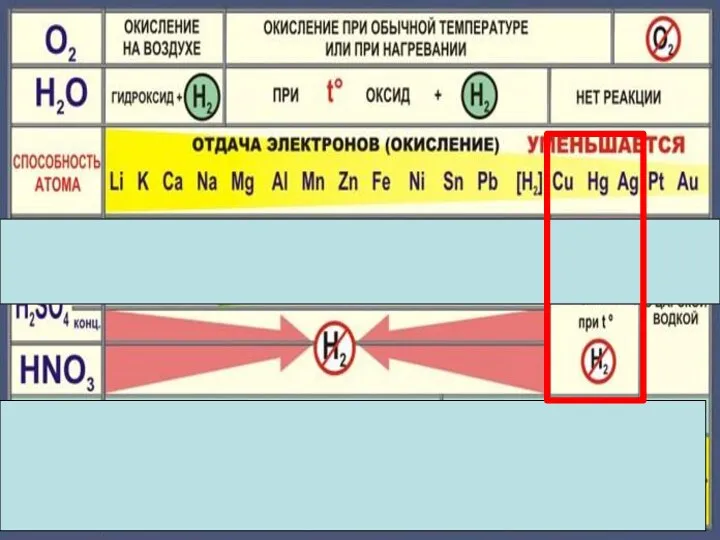
- 22. Cu + 2H2 SO4конц. = Cu SO4 +SO2 +2H2 O Cu + 4HNO3 конц. = Cu(NO3)2
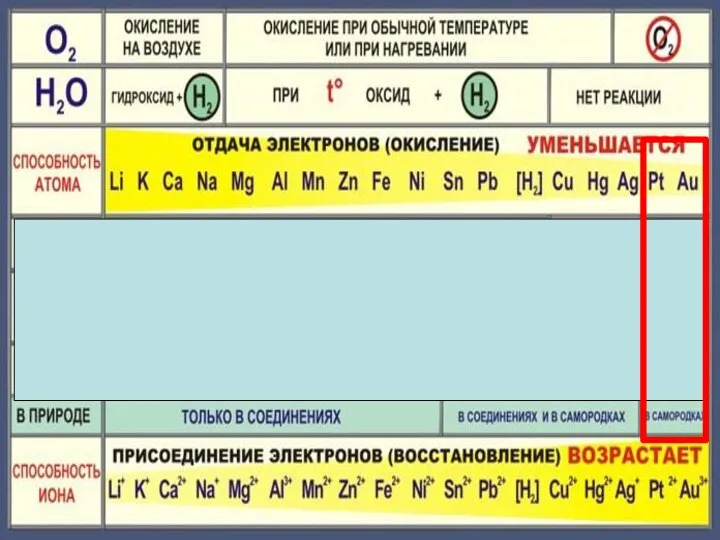
- 23. Состав «царской водки»: смесь концентрированных азотной HNO3 (65-68 % масс.) и соляной HCl (32-35 % масс.)
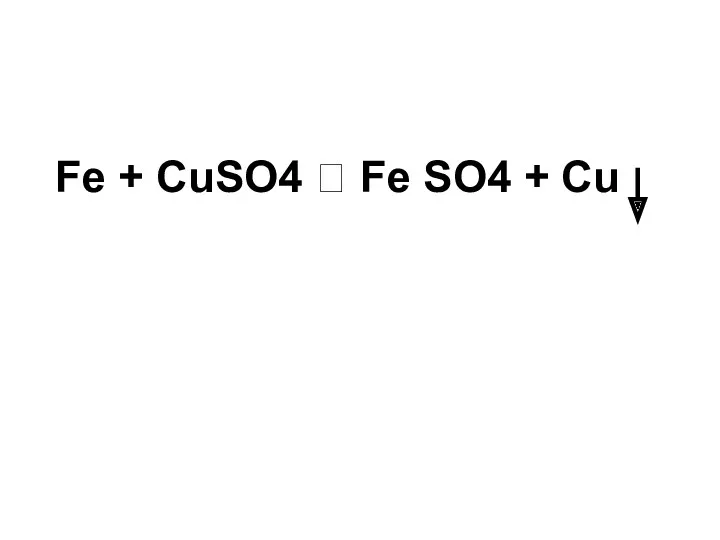
- 26. Fe + CuSO4 Fe SO4 + Cu
- 28. Скачать презентацию



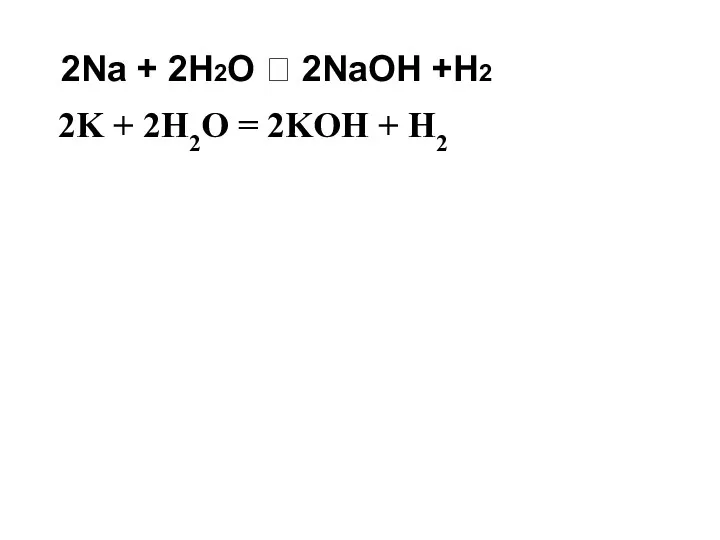


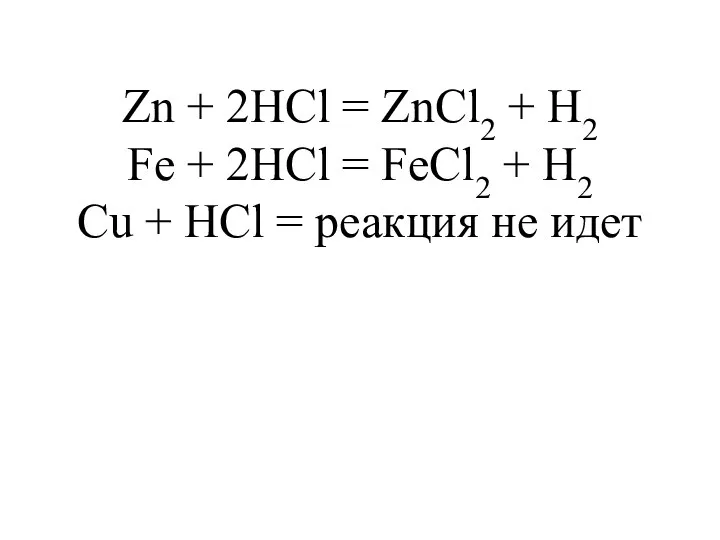
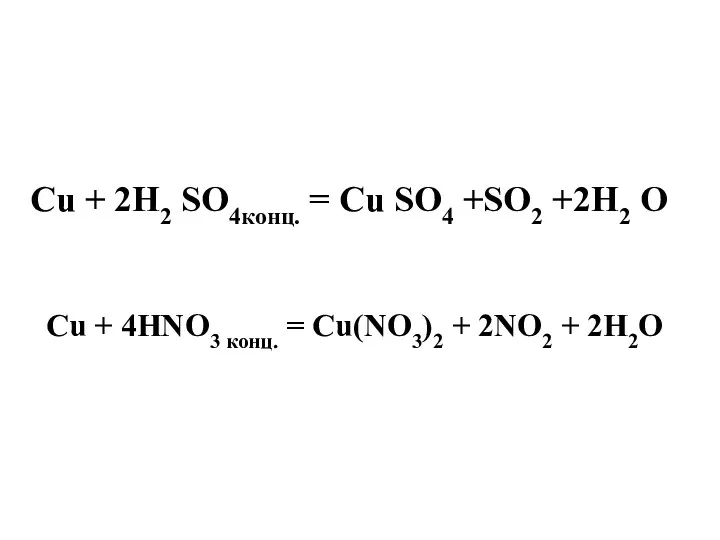

 Предложный падеж имён существительных
Предложный падеж имён существительных Отечественная поэзия в творчестве кубанских композиторов
Отечественная поэзия в творчестве кубанских композиторов Выделение физической химии в самостоятельную отрасль науки
Выделение физической химии в самостоятельную отрасль науки по теме: Добродетель и порок
по теме: Добродетель и порок Христос - наша Праведность (Оправдание) и наше Освящение Повторяем и закрепляем главные мысли
Христос - наша Праведность (Оправдание) и наше Освящение Повторяем и закрепляем главные мысли Экзистенциализм. Экзистенциональная философия Кьеркегора, Ясперса, Сартра, Камю, Хайдеггера
Экзистенциализм. Экзистенциональная философия Кьеркегора, Ясперса, Сартра, Камю, Хайдеггера Transport. Vocabulary
Transport. Vocabulary Культура и война
Культура и война Квантовые рэтчеты (выпрямители). Новый сверхпроводящий двухконтурный интерферометр
Квантовые рэтчеты (выпрямители). Новый сверхпроводящий двухконтурный интерферометр Образование и самообразование как путь в профессию
Образование и самообразование как путь в профессию Внеклассное мероприятие ко Дню Матери Сказ от сердца и души, о том, как мамы хороши! (1 - 4 классы)
Внеклассное мероприятие ко Дню Матери Сказ от сердца и души, о том, как мамы хороши! (1 - 4 классы) Загрязнение окружающей среды
Загрязнение окружающей среды Игра-презентация по Карточкам Ханса
Игра-презентация по Карточкам Ханса Легированные стали и сплавы. Цветные металлы и сплавы. Электротехнические, неметаллические и композиционные материалы
Легированные стали и сплавы. Цветные металлы и сплавы. Электротехнические, неметаллические и композиционные материалы Мы создаем хороший климат
Мы создаем хороший климат Атомная электростанция Казахстана
Атомная электростанция Казахстана Правитель Александр Невский
Правитель Александр Невский ЕГЭ. Задание 25. Пишем сочинение
ЕГЭ. Задание 25. Пишем сочинение Производство 19 века
Производство 19 века Клуб Молодая семья г. Великий Устюг МЦ Авангард
Клуб Молодая семья г. Великий Устюг МЦ Авангард Презентация Антарктида
Презентация Антарктида Магистральные трубопроводы
Магистральные трубопроводы Творчество Ивана Ивановича Шишкина
Творчество Ивана Ивановича Шишкина Мама... как много в этом слове
Мама... как много в этом слове Кубановедение. Хата казака.
Кубановедение. Хата казака. Культура Иудаизма
Культура Иудаизма Проект театрального кружка Сказка
Проект театрального кружка Сказка Есеп беру. Алматытелекомнын атқаратын қызметі. Транспорттық желінің сипаттамасы
Есеп беру. Алматытелекомнын атқаратын қызметі. Транспорттық желінің сипаттамасы