Содержание
- 2. Положение в периодической системе химических элементов Д.И.Менделеева Алюминий Аl — элемент главной подгруппы IIIА группы, 3
- 3. Охарактеризуйте положение алюминия в периодической системе Д.И. Менделеева ответ проверьте здесь
- 4. Алюминий Аl — элемент главной подгруппы IIIА группы, 3 малого периода. Надеюсь вы справились с заданием
- 5. Строение атома 1s2 2s2 2p6 3s2 3p1 Атом алюминия содержит на внешнем энергетическом уровне три электрона,
- 6. Выберите электронную формулу строения атома алюминия: а) 11s2 2s2 2p6 3s2 3p2 б) 11s2 2s2 2p6
- 7. Молодец!!! Так держать! далее
- 8. Нет, это неправильно Атом алюминия имеет следующую формулу строения : 1s2 2s2 2p6 3s2 3p1 Атом
- 9. Сколько электронов находится на внешнем энергетическом уровне атома алюминия? А) 2 Б) 3 В) 4 Г)
- 10. Молодец, верно!!! далее
- 11. Таблица1. Сравнение некоторых свойств элементов IIIА-подгруппы
- 12. Как изменяются металлические свойства и радиусы атомов в ряду: бор-алюминий-галлий-индий-таллий Металлические свойства увеличиваются, радиусы уменьшаются; Металлические
- 13. Абсолютно верно!!! Умница!!! далее
- 14. Нет, неправильно, вернитесь и повторите материал еще раз. далее
- 15. Нахождение в природе По количеству в земной коре алюминий занимает 3-е место после кислорода и кремния
- 16. Алюминий в организме Алюминий входит в состав тканей животных и растений; в органах млекопитающих животных обнаружено
- 17. Открытие алюминия Алюминий был впервые получен датским физиком X. Эрстедом в 1825г. Название этого элемента происходит
- 18. Тип химической связи и строение Алюминий — типичный металл; тип связи – МЕТАЛЛИЧЕСКИЙ; кристаллическая решетка -
- 19. Физические свойства Алюминий — мягкий, легкий, серебристо-белый металл с высокой тепло- и электропроводностью. Очень пластичен легко
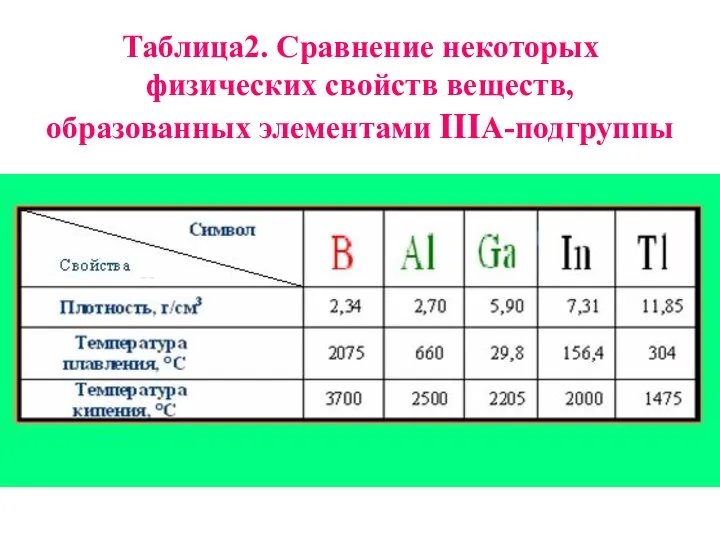
- 20. Таблица2. Сравнение некоторых физических свойств веществ, образованных элементами IIIА-подгруппы
- 21. Выберите свойства, характерные для алюминия: Пластичность Металлический блеск Тепло- и электропроводность Мягкость Блестящая поверхность Все характерны
- 22. Верно! далее
- 23. БУДЬ ВНИМАТЕЛЬНЕЕ! Это, конечно тоже правильный ответ, но алюминию присущи все эти свойства. далее
- 24. Это абсолютно не верный ответ! Следует вернуться и повторить материал еще раз
- 25. Химические свойства Al активный восстановитель.
- 26. Химические свойства Несмотря на активность, при комнатной температуре на воздухе алюминий практически не вступает в химические
- 27. Химические свойства 2.Если лишить алюминий защитной пленки или сделать ее рыхлой (например, погружением в раствор ртутных
- 28. Химические свойства 4.При комнатной температуре активно реагирует с галогенами: 2Al + 3Br2 = 2AlBr3 +Q при
- 29. Химические свойства 6.Взаимодействует с разбавленными кислотами: 2Al + 6HClразб = 2AlCl3 +3H2↑ 2Al + 3H2SO4разб= Al2
- 30. Химические свойства 7.Вытесняет металлы из их оксидов (алюминотермия): 2Al + Cr2О3= Al2O3 +2Cr +Q 8Аl +
- 31. Химические свойства 8.Вытеснение алюминием из растворов солей менее активных металлов часто затруднено защитной пленкой на поверхности
- 32. С какими веществами взаимодействует алюминий при обычных условиях? С разбавленными серной и соляной кислотой С концентрированными
- 33. Правильно!!! Попробуй написать уравнения этих реакций и проверь их здесь
- 34. 2Al + 6HClразб = 2AlCl3 +3H2↑ 2Al + 3H2SO4разб= Al2 (SO4)3 +3H2↑ Надеемся вам удалось верно
- 35. Неверно!!! Алюминий заимодействует с разбавленными кислотами: 2Al + 6HClразб = 2AlCl3 +3H2↑ 2Al + 3H2SO4разб= Al2
- 36. Для алюминия не характерно: Вытеснение из раствора солей менее активных металлов; Вытеснение металлов из их оксидов;
- 37. Неверно!!! Для алюминия характерно вытеснение алюминием из растворов солей менее активных металлов часто затруднено защитной пленкой
- 38. Неверно!!! Алюминий вытесняет металлы из их оксидов (алюминотермия): 2Al + Cr2О3= Al2O3 +2Cr +Q 8Аl +
- 39. Неверно!!! Если порошок алюминия или тонкую алюминиевую фольгу сильно нагреть, то они воспламенятся и сгорят ослепительным
- 40. Неверно!!! При комнатной температуре алюминий активно реагирует с галогенами: 2Al + 3Br2 = 2AlBr3 +Q при
- 41. Верно!!! Уже при комнатной температуре алюминий начнет энергично реагировать с водой с выделением водорода, ЕСЛИ лишить
- 42. Получение Первый промышленного способ производства алюминия предложил в 1854 французский химик А. Э. Сент-Клер Девиль: способ
- 43. Когда и кем был предложен способ получения алюминия, используемый на алюминиевых заводах в наши дни? В
- 44. Неверно. Алюминий был впервые получен датским физиком X. Эрстедом в 1825г. Название этого элемента происходит от
- 45. Верно!!! Алюминий был впервые получен датским физиком X. Эрстедом в 1825г. Название этого элемента происходит от
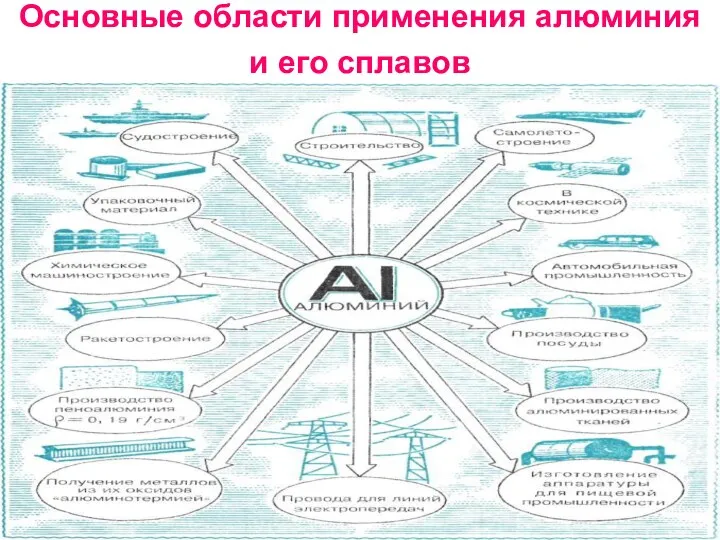
- 46. Основные области применения алюминия и его сплавов
- 47. Области применения алюминия и его соединений очень обширны. Перечисли некоторые из них. ответ проверь здесь
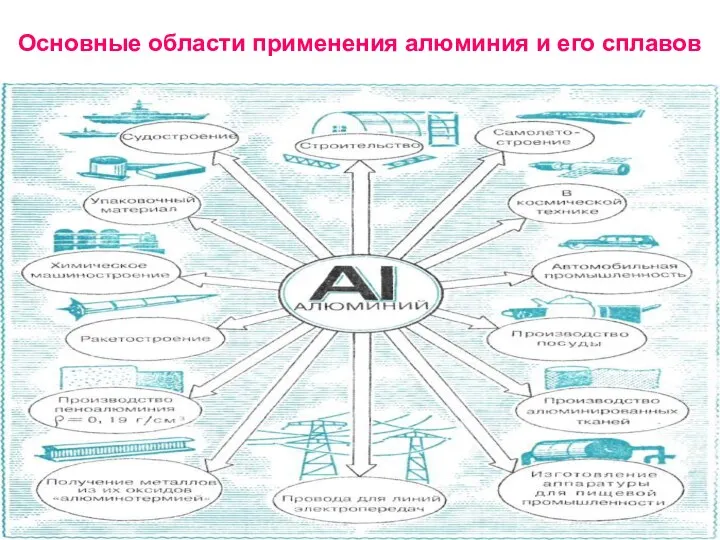
- 48. Основные области применения алюминия и его сплавов
- 50. Скачать презентацию











































 20231112_moralnyy_vybor_i_moralnaya_otsenka
20231112_moralnyy_vybor_i_moralnaya_otsenka Презентация Зимние забавы
Презентация Зимние забавы Оборудование системы посадки
Оборудование системы посадки Сортировка и подведения итогов в списке. Фильтрация списка
Сортировка и подведения итогов в списке. Фильтрация списка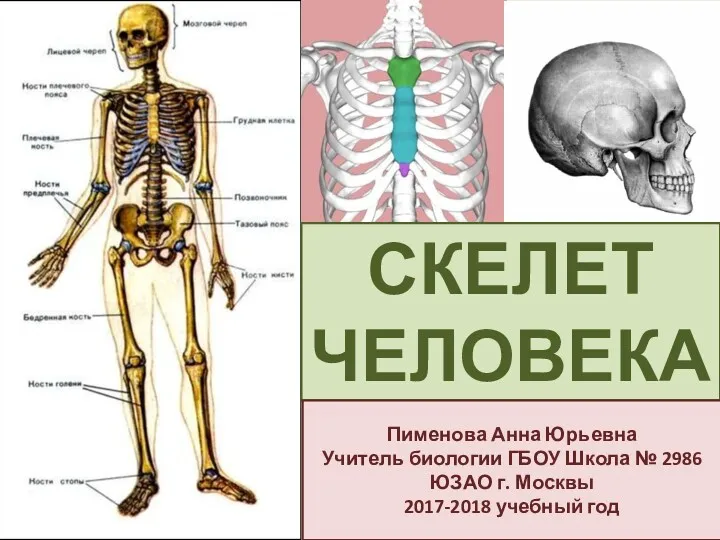 Скелет человека
Скелет человека Проект Мамы разные нужны, мамы всякие важны 2013-2014 уч.год
Проект Мамы разные нужны, мамы всякие важны 2013-2014 уч.год Деление с числами 0 и 1
Деление с числами 0 и 1 игра Космическое путешествие
игра Космическое путешествие Проблематика романа М. Булгакова Белая гвардия
Проблематика романа М. Булгакова Белая гвардия Антропогенные воздействия на атмосферу
Антропогенные воздействия на атмосферу Scanning tunneling microscope (STM)
Scanning tunneling microscope (STM) The reported speech
The reported speech Kp_Gladkikh_Ivan_Meo-03
Kp_Gladkikh_Ivan_Meo-03 Занятие внеурочной деятельности В мире книг. Викторина по сказке К.И. Чуковского Муха-Цокотуха
Занятие внеурочной деятельности В мире книг. Викторина по сказке К.И. Чуковского Муха-Цокотуха Система работы с кадрами МЧС
Система работы с кадрами МЧС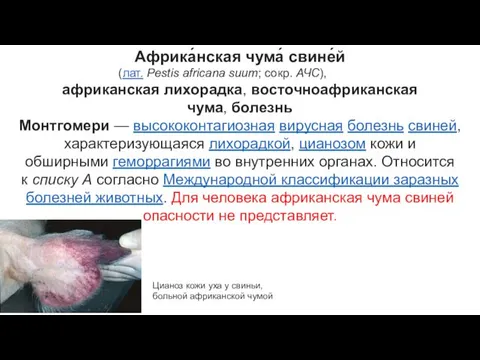 Африканская чума свиней
Африканская чума свиней Секрет учительского счастья
Секрет учительского счастья Соғыстан кейінгі Сталиндік кезеңдегі Қазақстан
Соғыстан кейінгі Сталиндік кезеңдегі Қазақстан презентация на семинар
презентация на семинар Родительское собрание Здоровая личность в здоровой семье
Родительское собрание Здоровая личность в здоровой семье Макроэлементы и микроэлементы
Макроэлементы и микроэлементы презентация Наш 9 класс
презентация Наш 9 класс Транспортировка нефти и газа
Транспортировка нефти и газа Презентация для конкурса Семеро козлят
Презентация для конкурса Семеро козлят Инвестиции в ценные бумаги
Инвестиции в ценные бумаги Специфика программ ДО и программ внеурочной деятельности
Специфика программ ДО и программ внеурочной деятельности Пожертвование во имя Всевышнего
Пожертвование во имя Всевышнего Хроническая сердечная недостаточность
Хроническая сердечная недостаточность