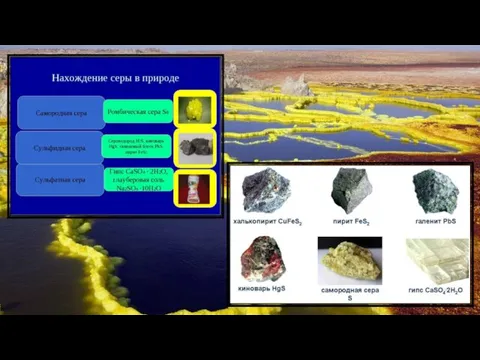
Слайд 15

Загрязнение атмосферы
Тепловые электростанции загрязняют атмосферу выбросами, которые содержат сернистый ангидрид, двуокись
серы, оксиды азота, сажу, пыль и золу, которые содержат соли тяжелых металлов.
Комбинаты черной металлургии, которые включают в себя доменное, сталеплавильное, прокатное производство, агломерационные фабрики, коксохимические заводы и др..
Цветная металлургия, которая загрязняет атмосферу соединениями цветных и тяжелых металлов, парами ртути, сернистым ангидридом, окисями азота, углевода и др..
Машиностроение и металлообработка. Выбросы этих предприятий содержат аэрозоли соединений цветных и тяжелых металлов, в том числе паров ртути. Нефтеперерабатывающая и нефтехимическая промышленность является источником таких загрязнителей атмосферы как сероводород , сернистый ангидрид , окись углерода , аммиак , углеводород и бензаперен .
Предприятия органической химии . Выбросы большого количества органических веществ которые имеют сложный химический состав, соляной кислоты ,соединений тяжелых металлов, содержат сажу и пыль.
Предприятия неорганической химии. Выбросы в атмосферу от этих предприятий содержат окиси серы и азота , соединения фосфора, свободный хлор, сероводород.
Автотранспорт . Географические закономерности распространения загрязнителей ,которые от него поступают очень сложные и определяются не только конфигурацией сети автомагистралей и интенсивностью автотранспорта ,но и большим количеством перекрестков ,где транспорт стоит определенное время с включенными двигателями . Количество транспорта во всем мире составляет 630 млн единиц .





















 Нервная система рыб
Нервная система рыб Введение в язык программирования Паскаль
Введение в язык программирования Паскаль Инфекционный контроль. Дезинфекция
Инфекционный контроль. Дезинфекция Противоаллергические препараты
Противоаллергические препараты Маркетингове дослідження вітчизняного ринку кондитерської продукції
Маркетингове дослідження вітчизняного ринку кондитерської продукції Мастер-класс для родителей по теме Учите детей правильно дышать
Мастер-класс для родителей по теме Учите детей правильно дышать Рынок труда
Рынок труда Формирование гражданской идентичности через воспитание экологической культуры у детей
Формирование гражданской идентичности через воспитание экологической культуры у детей Научные основы и история становления трасологической диагностики
Научные основы и история становления трасологической диагностики Творчество С.С. Прокофьева. Симфонический оркестр и его структура. Симфоническая сказка Петя и волк
Творчество С.С. Прокофьева. Симфонический оркестр и его структура. Симфоническая сказка Петя и волк Синий кит - самое большое существо на земле
Синий кит - самое большое существо на земле Информационно - коммуникационные технологии в системе работы ДОУ
Информационно - коммуникационные технологии в системе работы ДОУ Двойная роль букв Е, Ё, Ю, Я. Орфографическая минутка
Двойная роль букв Е, Ё, Ю, Я. Орфографическая минутка Техническое оснащение коммерческого банка
Техническое оснащение коммерческого банка Пиление столярной ножовкой
Пиление столярной ножовкой Высоцкий Владимир Семенович - поэт, прозаик, бард. Кому сказать спасибо, что - живой!
Высоцкий Владимир Семенович - поэт, прозаик, бард. Кому сказать спасибо, что - живой! Дорожная и землеройная техника. Машины разграждения. Тема № 5. Занятие № 3
Дорожная и землеройная техника. Машины разграждения. Тема № 5. Занятие № 3 презентация Зачем нужно беречь и охранять воду?
презентация Зачем нужно беречь и охранять воду? Буклет - Консультация для родителей .Что такое мнемотехника?
Буклет - Консультация для родителей .Что такое мнемотехника? Вариант контрольных материалов для проведения в 2020 году основного государственного экзамена по обществознанию
Вариант контрольных материалов для проведения в 2020 году основного государственного экзамена по обществознанию Виникнення автотрофного живлення та його зв΄язок з транспортом речовин
Виникнення автотрофного живлення та його зв΄язок з транспортом речовин Денежку наживай, да честь не продавай
Денежку наживай, да честь не продавай Понятие гражданского общества. Понятие правового государства. СМИ как четвертая ветвь власти
Понятие гражданского общества. Понятие правового государства. СМИ как четвертая ветвь власти Теплообменные оборудования
Теплообменные оборудования Среды жизни организмов
Среды жизни организмов Применение альтернативного оборудования при сборе и транспортировке нефти Сосновского и Стретенского месторождений
Применение альтернативного оборудования при сборе и транспортировке нефти Сосновского и Стретенского месторождений Здоровый образ жизни
Здоровый образ жизни Меланин түзуші ұлпаның,жүйке ұлпасының ісіктері,күрделі ісіктер
Меланин түзуші ұлпаның,жүйке ұлпасының ісіктері,күрделі ісіктер