Содержание
- 2. ЛЕКЦИЯ №5 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) ОП. 05 Химия 1 курс 1 семестр Составитель: преподаватель Кобзева Марина
- 3. Определение ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР) – РЕАКЦИИ, В КОТОРЫХ ПРОИСХОДИТ ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ АТОМОВ ИЛИ
- 4. Степень окисления Условный электрический заряд атома (окислительное число) в молекуле, который мог бы возникнуть при отдаче
- 5. Степень окисления H+2O-2, S+6O-23, Fe+3Cl-3, C+4O-22, H+2C+4O-23, K+Mn+7O-24, K+2Cr+62O-27 Na+, Li+, K+, Ba+2, Mg+2 Водород имеет
- 6. Степень окисления Cтепень окисления атомов или ионов в соединении NH4NO3 NH4NO3 = NH4+ + NO3 –
- 7. Основные положения электронно-ионной теории Окисление – процесс отдачи электронов атомом или ионом, сопровождающийся повышением положительной степени
- 8. Восстановление – процесс присоединения атомом или ионом электронов, сопровождающийся понижением положительной степени окисления Mn+7 + 5e-
- 9. Основные положения электронно-ионной теории Восстановители – вещества, атомы или ионы, которых в процессе реакции отдают электроны
- 10. ВОССТАНОВИТЕЛИ нейтральные атомы; отрицательно заряженные ионы; положительно-заряженные ионы, отдающие электроны
- 11. Основные положения электронно-ионной теории Окислители – вещества, атомы или ионы, которых в процессе реакции присоединяют электроны
- 12. Важнейшие окислители KMnO4 K2Cr2O7 (в сернокислой среде) HNO3 НClO3 и соли хлораты H2O2 HClO и соли
- 13. Неблагородные металлы, Водород Уголь и кремний Оксид углерода CO Отрицательно заряженные ионы с низшей степенью окисления
- 14. ВЫВОДЫ: Если в реакции степень окисления (окислительное число) атома или иона уменьшается, то происходит принятие электронов,
- 15. Окислительно-восстановительный процесс протекает одновременно и является единством двух противоположных процессов – окисления и восстановления. В окислительно-восстановительной
- 16. ИЗМЕНЕНИЕ ОКИСЛИТЕЛЬНОГО ЧИСЛА ЭЛЕМЕНТОВ ← ← ← ← Восстановление (присоединение электронов – окислительное число понижается) -4
- 17. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОВР: В ОВР происходит эквивалентный, равноценный обмен электронов между окислителем и восстановителем. Общее число
- 18. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОВР: В ОВР освобождающийся кислород в состоянии иона О2- в кислых растворах связывается с
- 19. СОСТАВЛЕНИЕ УРАВНЕНИЙ ОВР: О-2 + 2Н+ = Н2О НОН + О2- = 2ОН-
- 20. Методы составления ОВР Метод электронного баланса, основанный на определении общего количества электронов, перемещающихся от восстановителя к
- 21. Метод электронного баланса KMnO4+KI+H2SO4 = MnSO4+I2+K2SO4+H2O I этап. Определяют и записывают величины и знаки окислительных чисел
- 22. Метод электронного баланса II этап. Определяют изменения, происшедшие в значениях окислительных чисел. Перемещение электронов записывают в
- 23. Уравнения электронного баланса реакций Дополнительный множитель Mn+7 + 5е → Mn+2 2 восстановление (окислитель) 10 2I-
- 24. Метод электронного баланса III этап. Выставляют дополнительные множители. Расстановку коэффициентов проводят сопоставлением чисел атомов и ионов
- 25. Метод электронного баланса IV этап. Определяют количество молекул воды в левой и правой частях уравнения из
- 26. Метод электронного баланса Основное уравнение реакции 2KMnO4+10KJ+8H2SO4 = 2MnSO4+5J2+6K2SO4+8H2O
- 28. Скачать презентацию

























 Классный час. Тема: День защитника отечества 4 класс
Классный час. Тема: День защитника отечества 4 класс Презентация ХРАМЫ МОСКОВСКОГО КРЕМЛЯ
Презентация ХРАМЫ МОСКОВСКОГО КРЕМЛЯ Prezentatsia_k_VKR
Prezentatsia_k_VKR Астероиды. Кометы. Метеоры. Метеориты.
Астероиды. Кометы. Метеоры. Метеориты.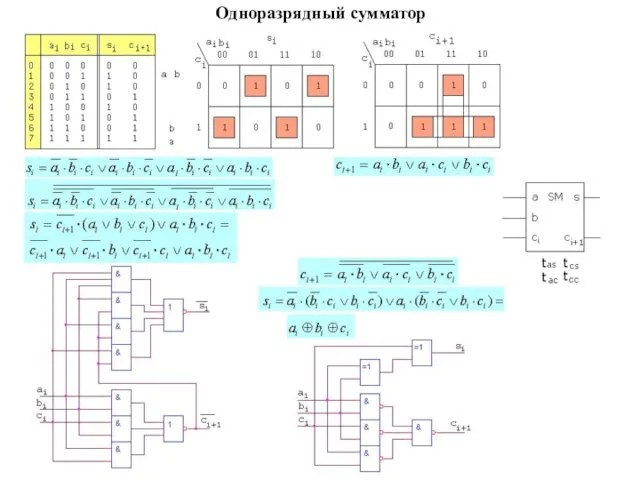 Одноразрядный сумматор
Одноразрядный сумматор Институт физической культуры, спорта и туризма
Институт физической культуры, спорта и туризма Презентация (2007) Цветы из салфеток
Презентация (2007) Цветы из салфеток Розрахункова схема дорожнього одягу та її розвиток. Лекція №2
Розрахункова схема дорожнього одягу та її розвиток. Лекція №2 Самостоятельная работа в колледже
Самостоятельная работа в колледже Гидродинамика пароводяного тракта котельных установок
Гидродинамика пароводяного тракта котельных установок Опыт реализации проектов строительства солнечных электростанций и результаты их эксплуатации в Республике Башкортостан
Опыт реализации проектов строительства солнечных электростанций и результаты их эксплуатации в Республике Башкортостан стенгазета Июль
стенгазета Июль Моя малая родина
Моя малая родина Обеспечение безопасности технических систем. Лекция 1
Обеспечение безопасности технических систем. Лекция 1 Қан топтары. Қан құю әдісі
Қан топтары. Қан құю әдісі Г.О.Засекин - основатель Саратова
Г.О.Засекин - основатель Саратова Презентация к уроку Кислородсодержащие вещества
Презентация к уроку Кислородсодержащие вещества Советские военнопленные в период Великой Отечественной войны – уроженцы Ардатовского района Мордовии
Советские военнопленные в период Великой Отечественной войны – уроженцы Ардатовского района Мордовии KLYuCh_10_OPERATsIONKI
KLYuCh_10_OPERATsIONKI От мудрости Востока к европейской христианской культуре: Библия
От мудрости Востока к европейской христианской культуре: Библия часовые пояса
часовые пояса Легоазбука для водителей и пешеходов
Легоазбука для водителей и пешеходов Экономика образования. Сущность материально-технической базы и состав фондов образования
Экономика образования. Сущность материально-технической базы и состав фондов образования Рельеф России
Рельеф России Новгородская земля в годы оккупации 1941 - 1944
Новгородская земля в годы оккупации 1941 - 1944 зачет англ
зачет англ Вехи развития атомной энергетики
Вехи развития атомной энергетики Лицензирование деятельности в сфере НИОКР и ее особенности для оборонной отрасли
Лицензирование деятельности в сфере НИОКР и ее особенности для оборонной отрасли