Содержание
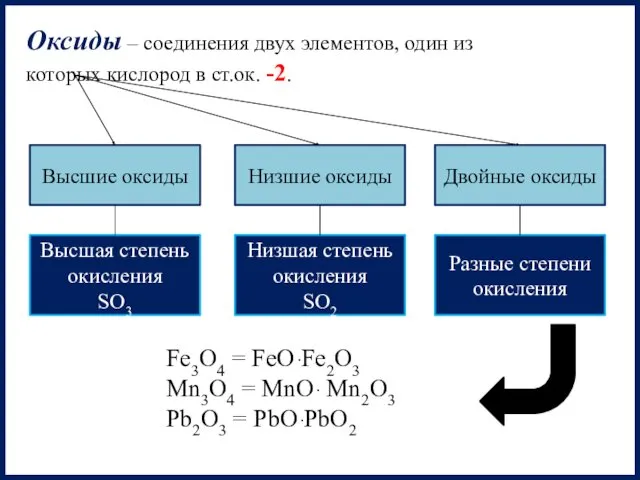
- 2. Оксиды – соединения двух элементов, один из которых кислород в ст.ок. -2. Высшие оксиды Низшие оксиды
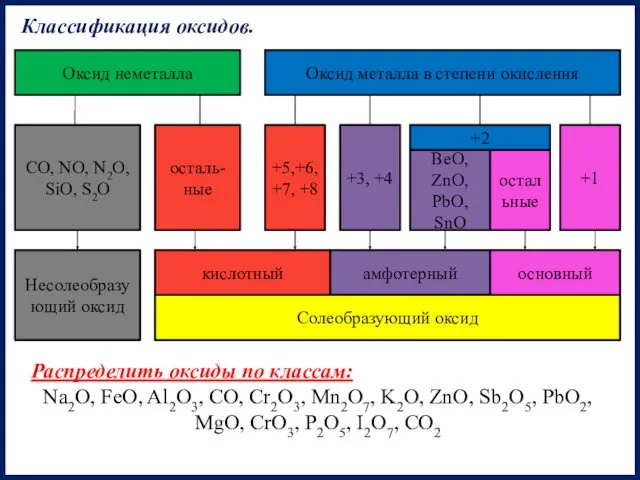
- 3. Оксид неметалла Оксид металла в степени окисления CO, NO, N2O, SiO, S2O осталь-ные +5,+6, +7, +8
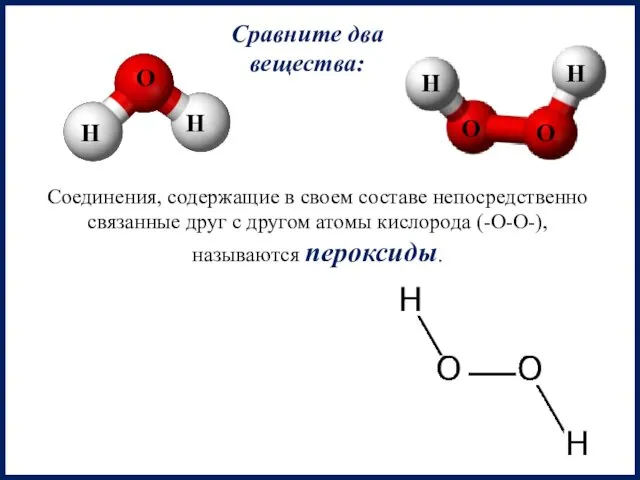
- 4. Сравните два вещества: Соединения, содержащие в своем составе непосредственно связанные друг с другом атомы кислорода (-О-О-),
- 5. 1. Дать названия веществам, выделить оксиды: H2O, CO2, As2O3, P2O5, I2O7, SO2, OF2, H2O2, HClO, SO3,
- 6. 4. Определи элементы по следующим данным: Элемент V группы, образует высший оксид, в котором суммарное число
- 7. Несолеобразующие оксиды CO, NO, N2O, SiO, S2O В химические реакции вступают редко Безразличны к кислотам и
- 9. Исключения: Оксиду P2O5 соответствуют 3 кислоты – HPO3, H4P2O7, H3PO4. Оксиду CrO3 соответствуют 2 кислоты –H2Cr2O7
- 10. Составь графические формулы гидроксидов, соответствующих оксиду: N2O3, P2O5, NO2, BeO, CrO3, CO, CO2, Co2O3, Cl2O7.
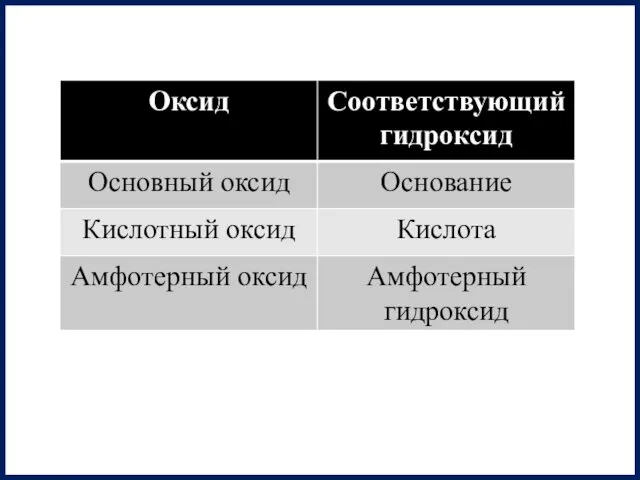
- 11. Основные оксиды Оксиды, которым соответствуют гидроксиды-основания. Твердые ионные кристаллы, высокие температуры плавления и кипения
- 12. Химические свойства основных оксидов: Основный оксид Щелочь Вода 1 + = С водой взаимодействуют только оксиды
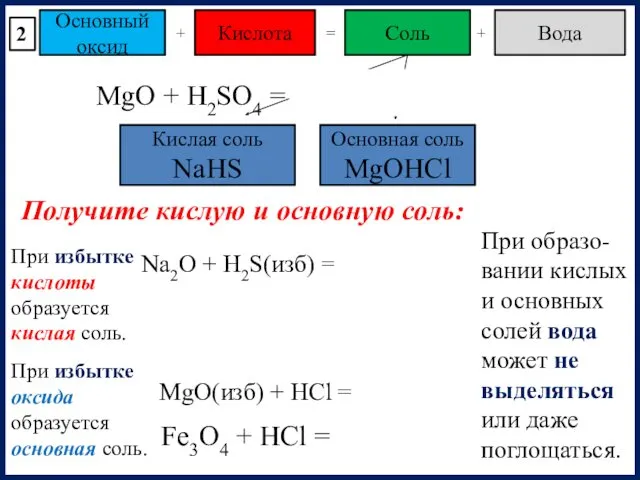
- 13. Основный оксид Соль Кислота + = Вода + MgO + H2SO4 = MgSO4 + H2O Кислая
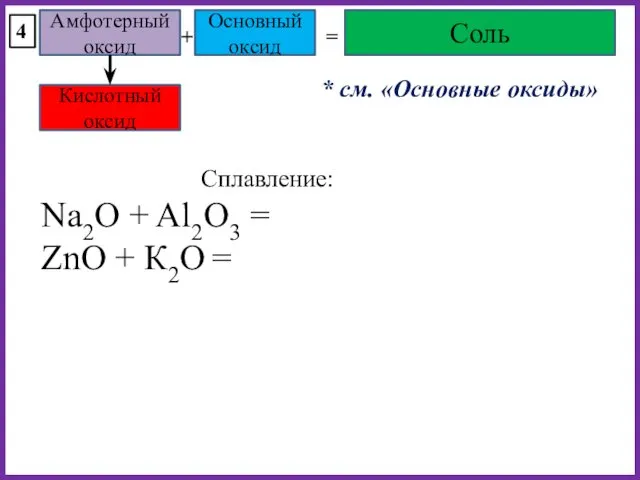
- 14. Основный оксид Соль Кислотный оксид / Амфотерный + = Реакции между твердыми оксидами идут при нагревании
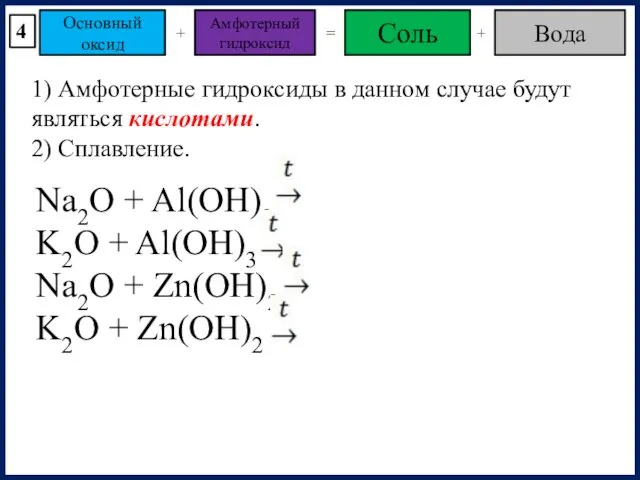
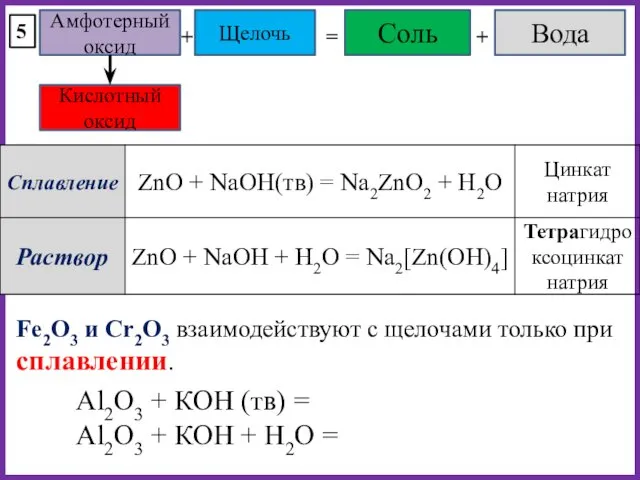
- 15. Основный оксид Амфотерный гидроксид + = Соль Вода + 1) Амфотерные гидроксиды в данном случае будут
- 16. Окислительно-восстановительные реакции основных оксидов: Восстановление: При нагревании разлагаются оксиды благородных металлов и ртути. При высокой температуре
- 17. Дз Скан Дерябина с 25 (на компе в каб 301)
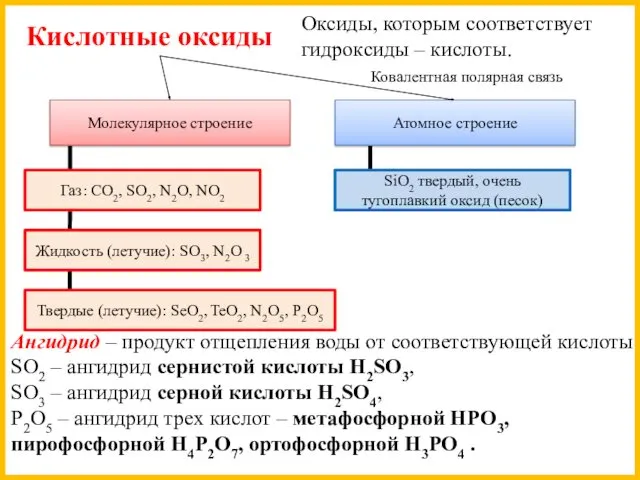
- 18. Кислотные оксиды Оксиды, которым соответствует гидроксиды – кислоты. Ковалентная полярная связь Молекулярное строение Атомное строение Газ:
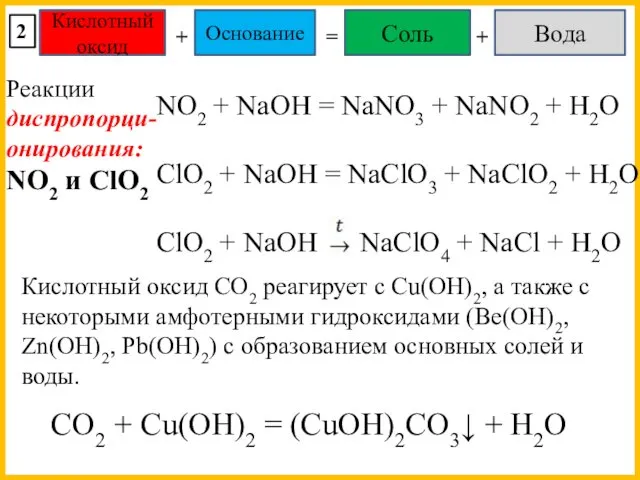
- 19. Химические свойства кислотных оксидов: Кислотный оксид Кислота Вода + = 1) Ст.ок. сохраняется. 2) Реакции диспропорционирования:
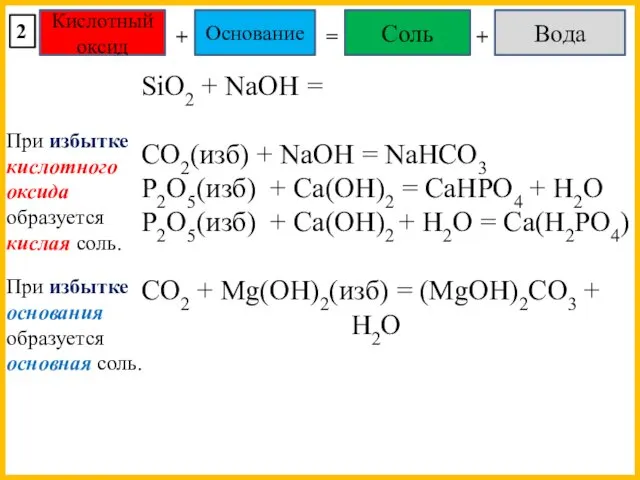
- 20. Кислотный оксид Основание + = Соль Вода + 2 SiO2 + NaOH = CO2(изб) + NaOH
- 21. Кислотный оксид Основание + = Соль Вода + 2 NO2 + NaOH = NaNO3 + NaNO2
- 22. Кислотный оксид Соль Основный оксид / Амфотерный + = Реакции между твердыми оксидами идут при нагревании
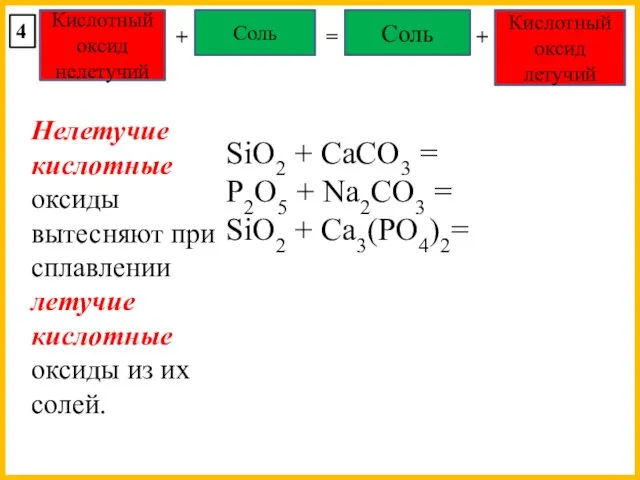
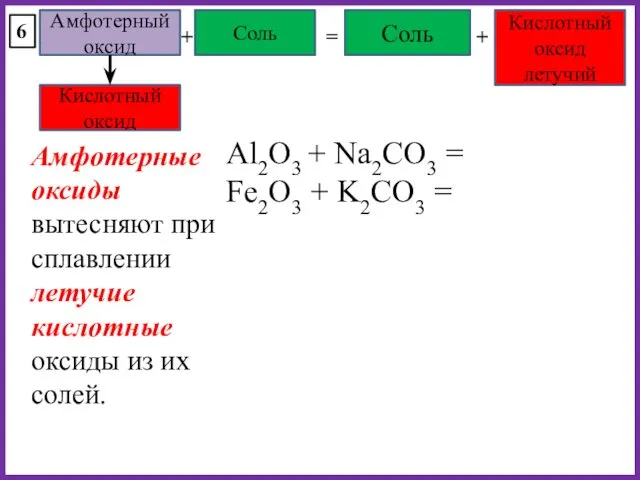
- 23. Кислотный оксид нелетучий Соль + = Соль Кислотный оксид летучий + 4 SiO2 + СaCO3 =
- 24. Окислительно-восстановительные реакции кислотных оксидов: Восстановление: При высокой температуре С и H2 восстанавливают оксиды (частично или полностью).
- 25. Окислительно-восстановительные реакции кислотных оксидов: Восстановление: При высокой температуре С и H2 восстанавливают оксиды (частично или полностью).
- 26. Домашнее задание
- 27. Составь уравнения реакций, соответствующие схемам:
- 28. Амфотерные оксиды Проявляют кислотные и основные свойства. Ст.ок. +3, +4 BeO ZnO PbO SnO
- 29. Амфотерный оксид Вода + ≠ 1 Химические свойства амфотерных оксидов: Al2O3 + H2O ≠
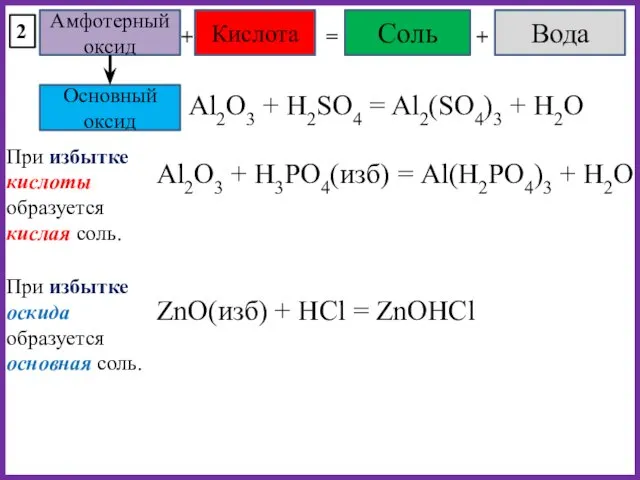
- 30. Амфотерный оксид Кислота + = Соль Вода + 2 При избытке кислоты образуется кислая соль. При
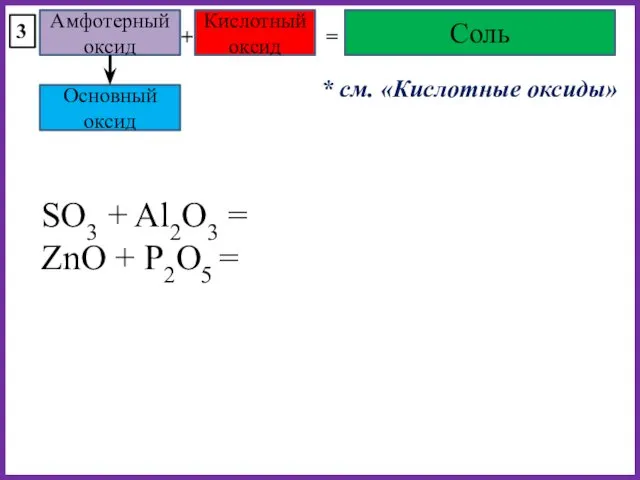
- 31. Амфотерный оксид Кислотный оксид + = Соль 3 SO3 + Al2O3 = ZnO + P2O5 =
- 32. Амфотерный оксид Основный оксид + = Соль 4 Na2O + Al2O3 = ZnO + К2O =
- 33. Амфотерный оксид Щелочь + = 5 Соль Вода + Кислотный оксид Fe2O3 и Cr2O3 взаимодействуют с
- 34. Соль + = Соль Кислотный оксид летучий + 6 Al2O3 + Na2CO3 = Fe2O3 + K2CO3
- 36. Скачать презентацию


















 Христианство. Становление
Христианство. Становление Arduino - это инструмент для проектирования электронных устройств (электронный конструктор)
Arduino - это инструмент для проектирования электронных устройств (электронный конструктор) Характеристика основных элементов регулярного приема планировки
Характеристика основных элементов регулярного приема планировки Хозяйство Германии
Хозяйство Германии Открытый урок Сложные эфиры. Жиры.
Открытый урок Сложные эфиры. Жиры. Использование метода наглядного моделирования в работе с дошкольниками
Использование метода наглядного моделирования в работе с дошкольниками прзтц
прзтц Історичні персоналії
Історичні персоналії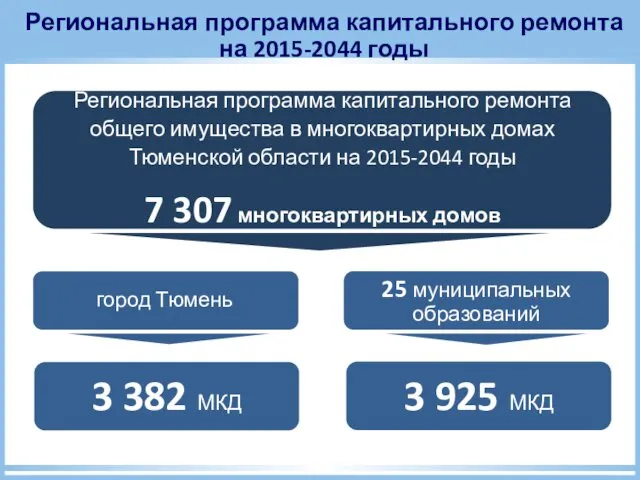 Региональная программа капитального ремонта на 2015-2044 годы
Региональная программа капитального ремонта на 2015-2044 годы сценарий классного часа День Знаний 2 класс
сценарий классного часа День Знаний 2 класс Абдоминальное ожирение и риск развития атеросклеротических процессов и инсулинорезистенции
Абдоминальное ожирение и риск развития атеросклеротических процессов и инсулинорезистенции Список личного снаряжения для однодневного турпохода весной/осенью
Список личного снаряжения для однодневного турпохода весной/осенью Программа развития школьного историко-краеведческого музея
Программа развития школьного историко-краеведческого музея одарённые дети
одарённые дети Презентация Развитие способностей и творческого потенциала всех детей в условиях реализации ФГОС ДО
Презентация Развитие способностей и творческого потенциала всех детей в условиях реализации ФГОС ДО Презентация для родителей будущих первоклассников
Презентация для родителей будущих первоклассников Воспитатель года.
Воспитатель года. Сопряжения. Виды сопряжений
Сопряжения. Виды сопряжений Великие географические открытия Колумба
Великие географические открытия Колумба Юбка. Конструирование
Юбка. Конструирование
 Русская философская мысль
Русская философская мысль Ядерная физика и человек
Ядерная физика и человек Диалоговое обучение (обучение как открытие)
Диалоговое обучение (обучение как открытие) Социальное пространство и социальная структура
Социальное пространство и социальная структура Проект по патриотическому воспитанию к 70-летию Победы
Проект по патриотическому воспитанию к 70-летию Победы Ведомственный проект Цифровое сельское хозяйство
Ведомственный проект Цифровое сельское хозяйство Основы поведения субъектов рыночной экономики
Основы поведения субъектов рыночной экономики