Содержание
- 2. Хімічна термодинаміка вивчає перетворення енергії при хімічних реакціях та здатність хімічних систем виконувати корисну роботу. Завдання
- 3. Будь-які хімічні реакції завжди супроводжуються тими або іншими енергетичними ефектами: виділенням або поглинанням теплоти, світла, здійсненням
- 4. Основные понятия и определения
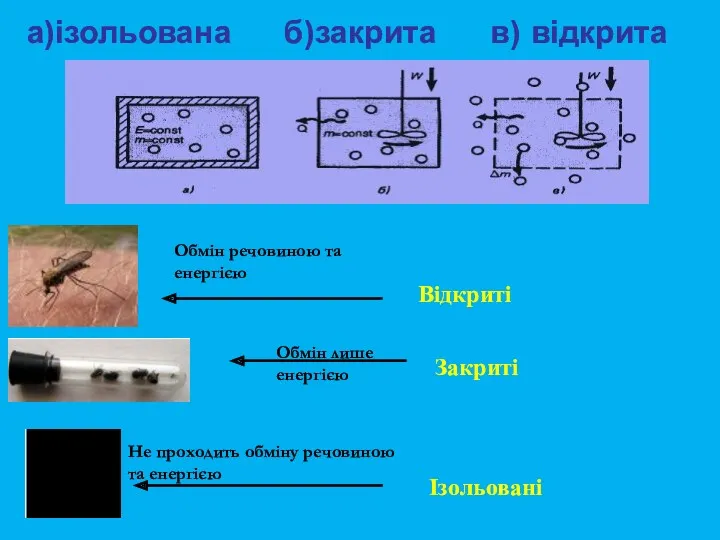
- 6. Відкриті Закриті Ізольовані Не проходить обміну речовиною та енергією Обмін речовиною та енергією Обмін лише енергією
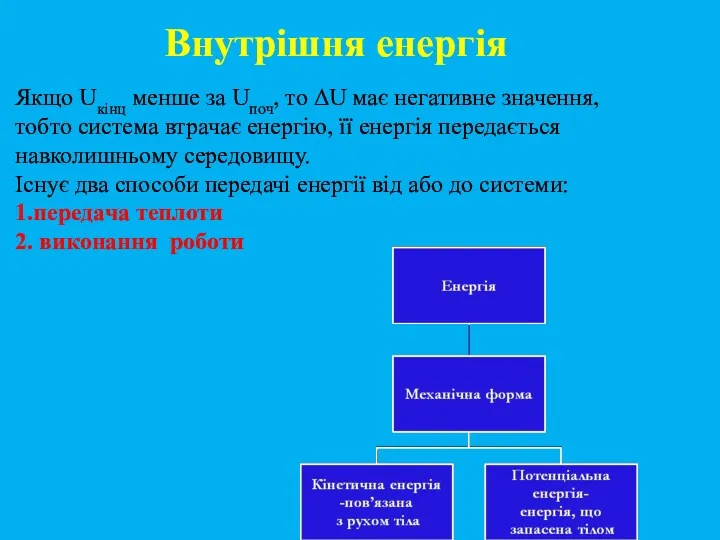
- 11. Якщо Uкінц менше за Uпоч, то ΔU має негативне значення, тобто система втрачає енергію, її енергія
- 12. Види енергії Кінетична + потенціальна енергія частинок становить внутрішню енергію системи. Кінетична енергія обумовлена рухом частинок.
- 13. Основные понятия и определения
- 15. Перший закон термодинаміки Перший закон термодинаміки – одна із форм закону збереження енергії Енергія не створюється
- 20. Тепловий ефект відносять або до всієї реакції (одиниця – кДж), або до 1 моль одного з
- 23. Застосування законів Гесса для реакцій електролітичної дисоціації NaCl + aq = Na+aq + Cl-aq ΔНf°298 -410,9
- 24. Тепловий ефект розчинення характеризує хімічну взаємодію молекул розчинника з розчиненою речовиною і залежить від : кількості
- 25. Утворення СО2 при безпосередній взаємодії простих речовин: С(графіт) +О2(г) = СО2(г) ΔН1 = -393, 6 кДж,
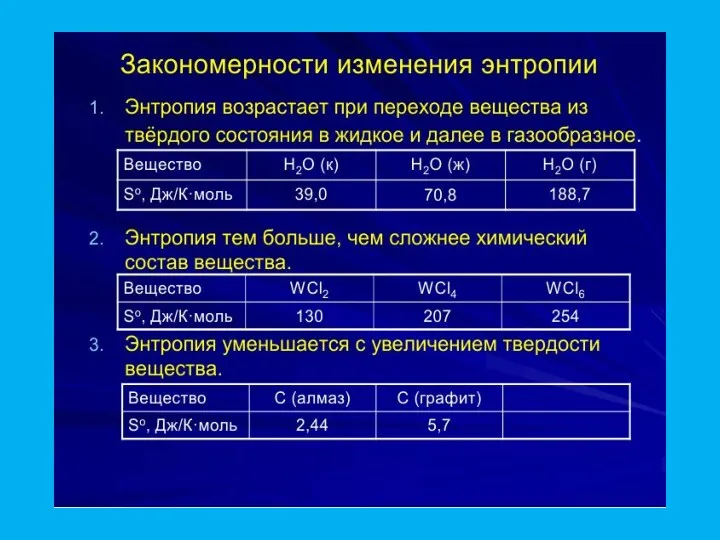
- 28. Статистическаое определение энтропии В изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к увеличению
- 33. Для обрахунків ентропії системи користуються наступним рівнянням: ΔSх.р. = Σ Sfпрод.р - Σ Sfвих.р Для реакції
- 40. Енергія Гіббса є критерієм самочинного протікання хімічних реакцій та термодинамічної стійкості хімічних сполук. Будь-яка система прагне
- 41. Розрахунки ΔG при Т ≠298 К і С≠1М Для процесу в загальному вигляді: aA + bB→
- 43. Скачать презентацию





































 Компетенция личностного самосовершенствования
Компетенция личностного самосовершенствования Разработка ресурсосберегающего способа производства топливно-плавильных материалов на основе техногенного сырья (Н3)
Разработка ресурсосберегающего способа производства топливно-плавильных материалов на основе техногенного сырья (Н3) Изготовление декоративного изделия 3D ручкой like
Изготовление декоративного изделия 3D ручкой like Готовая преза с триггерами
Готовая преза с триггерами урок по теме Карбоновые кислоты
урок по теме Карбоновые кислоты Операции Банка России на финансовом рынке. Лекция №4
Операции Банка России на финансовом рынке. Лекция №4 Общая краниология. Общие сведения о черепе
Общая краниология. Общие сведения о черепе Социальная психология личности
Социальная психология личности Роль физической культуры в сохранении здоровья
Роль физической культуры в сохранении здоровья Речь монологическая и диалогическая
Речь монологическая и диалогическая Холокост в литературе. То что забыть нельзя
Холокост в литературе. То что забыть нельзя Земля – уникальная планета (Урок-презентация).
Земля – уникальная планета (Урок-презентация). Мишка. Найди 3 отличия
Мишка. Найди 3 отличия Термодинамические процессы идеальных газов
Термодинамические процессы идеальных газов We're having a great time
We're having a great time Цветотерапия Попугаи
Цветотерапия Попугаи Фестиваль гражданского общества Добрые люди
Фестиваль гражданского общества Добрые люди ПрезентацияХлеб всему голова
ПрезентацияХлеб всему голова Родительское собрание для 1 класса.
Родительское собрание для 1 класса. Ауруханадан тыс пневманиямен ауыратын науқастарды емдеу кезіндегі пенициллин мен цефтриаксонның салыстырмалы
Ауруханадан тыс пневманиямен ауыратын науқастарды емдеу кезіндегі пенициллин мен цефтриаксонның салыстырмалы Обществознание и общественные науки
Обществознание и общественные науки Полиомиелит. Мероприятия в отношении больных полиомиелитом, острыми вялыми параличами
Полиомиелит. Мероприятия в отношении больных полиомиелитом, острыми вялыми параличами Угол. Измерение углов
Угол. Измерение углов Пищевая и легкая промышленность
Пищевая и легкая промышленность Настройка компьютера. Компьютерный вирус
Настройка компьютера. Компьютерный вирус Призентация творческого проекта Мягкая игрушка
Призентация творческого проекта Мягкая игрушка ОГАС 2.0. Программно-техническое решение системы (часть 2)
ОГАС 2.0. Программно-техническое решение системы (часть 2) Формирование стратегии и школы стратегического управления
Формирование стратегии и школы стратегического управления