Содержание
- 2. Цели урока Обобщить сведения об ионах Закрепить умение записывать процесс диссоциации при помощи химических знаков и
- 3. ПРОВЕРЬ СВОИ ЗНАНИЯ Вещества, растворы которых проводят электрический ток, называют ……… Процесс распада электролита на ионы
- 4. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните схему) ЭЛЕКТРОЛИТЫ (по степени электролитической диссоциации )
- 5. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните таблицу)
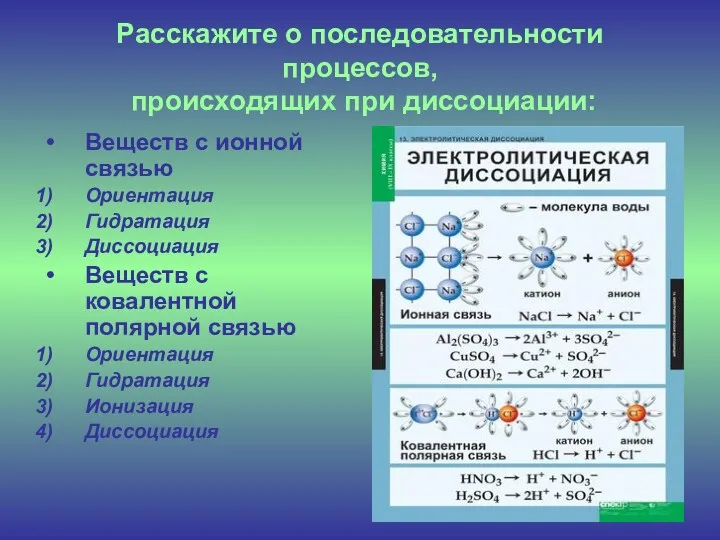
- 6. Расскажите о последовательности процессов, происходящих при диссоциации: Веществ с ионной связью Ориентация Гидратация Диссоциация Веществ с
- 7. История открытия теории электролитической диссоциации В 1887 году шведский химик Сванте Аррениус сформулировал основные положения теории
- 8. Основные положения ТЭД При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. NaCl
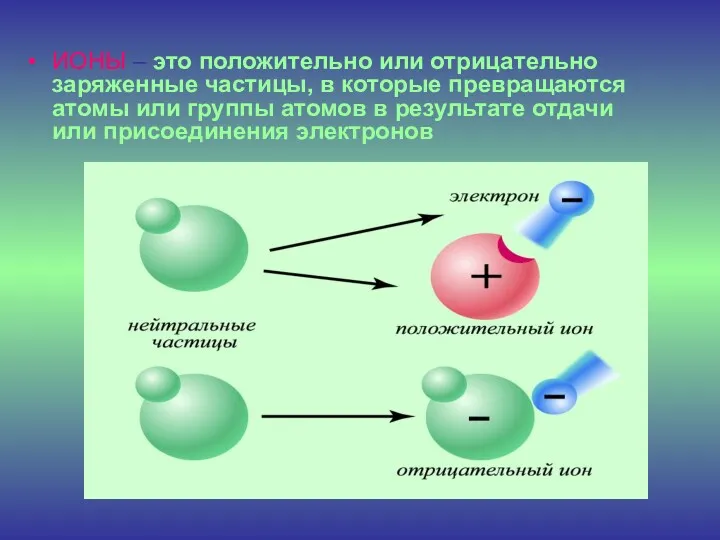
- 9. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
- 10. ЭЛЕКТРОННЫЕ ФОРМУЛЫ +11Na0 2ē 8ē 1ē +11Na+ 2ē 8ē атом ион +17Cl0 2ē 8ē 7ē +17Cl0
- 11. ИОНЫ (по составу) ПРОСТЫЕ Например: Cl- K+ СЛОЖНЫЕ Например: NO3- SO42-
- 12. Основные положения ТЭД 2. Причиной диссоциации электролита в водном растворе является его гидратация, т.е. взаимодействие электролита
- 13. ИОНЫ (по наличию водной оболочки) ГИДРАТИРОВАННЫЕ Например: В растворах и кристаллогидратах CuSO4 * 5H2O Na2SO4* 10H2O
- 14. Основные положения ТЭД 3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника
- 15. ИОНЫ (по знаку заряда) КАТИОНЫ положительно заряженные частицы АНИОН отрицательно заряженные частицы
- 16. Основные положения ТЭД 4. Электролитическая диссоциация – процесс обратимый для слабых электролитов. Наряду с процессом диссоциации
- 17. Основные положения ТЭД 5. Не все электролиты в одинаковой мере диссоциируют на ионы.
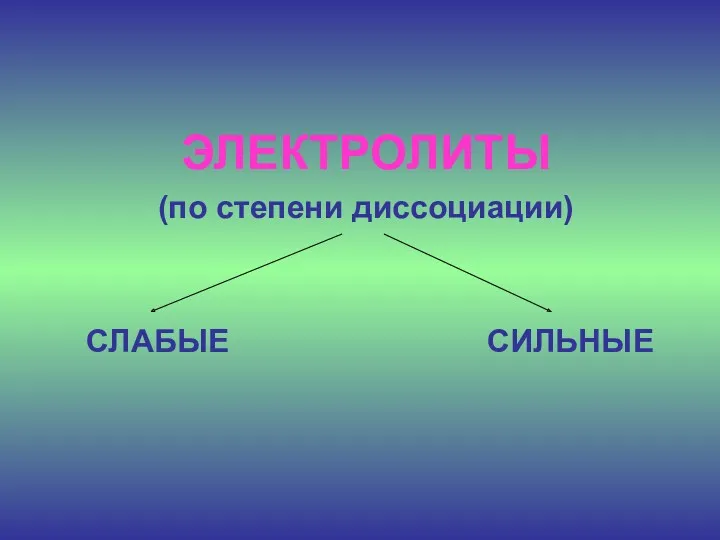
- 18. ЭЛЕКТРОЛИТЫ (по степени диссоциации) СЛАБЫЕ СИЛЬНЫЕ
- 19. Основные положения ТЭД 6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при
- 20. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов) КИСЛОТЫ ОСНОВАНИЯ СОЛИ
- 21. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) HCl 2) HNO3 3) Н2SiO3
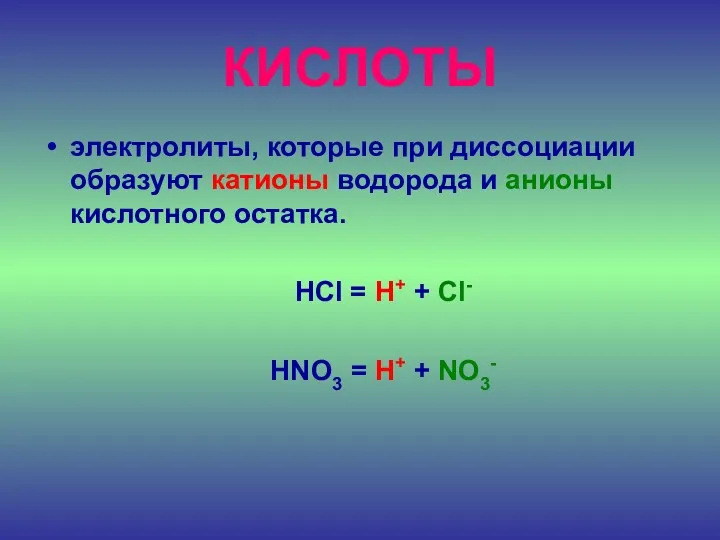
- 22. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Кислоты – это электролиты, которые диссоциируют на катионы и анионы
- 23. КИСЛОТЫ электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HCl = H+ +
- 24. Многоосновные кислоты диссоциируют ступенчато H3PO4 (фосфорная кислота) 1) Образование дигидрофосфат-ионов H3PO4 ↔ H+ + H2PO4- 2)
- 25. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaOH 2) KOH 3) Fe(OH)2
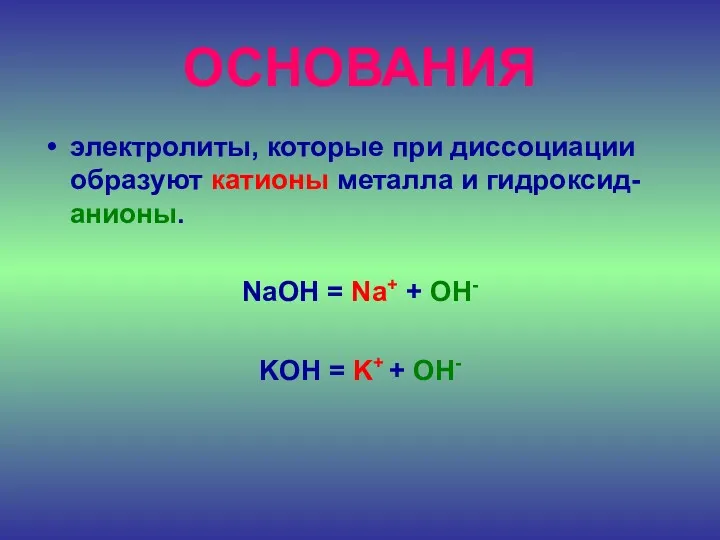
- 26. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Основания – это электролиты, которые диссоциируют на катионы и анионы
- 27. ОСНОВАНИЯ электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. NaOH = Na+ + OH- KOH
- 28. Многокислотные основания диссоциируют ступенчато Ba(OH)2 (гидроксид бария) 1) Образование гидроксо-ионов бария Ba(OH)2 ↔ OH- + BaOH+
- 29. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaCl 2) KNO3 3) BaSO4
- 30. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Cоли – это электролиты, которые диссоциируют на катионы и анионы
- 31. СОЛИ электролиты, которые при диссоциации образуют катионы металла (или аммония NH4) и анионы кислотных остатков. K3PO4
- 32. ПРОВЕРЬ СВОИ ЗНАНИЯ Пользуясь таблицей растворимости, приведите примеры трех веществ, которые в растворах образуют сульфат-ионы. Запишите
- 34. Скачать презентацию
























 Моя семья. Чулакова Найле
Моя семья. Чулакова Найле Где же наши Парамоновичи? М.Ю.Лермонтов. 8 Б класс
Где же наши Парамоновичи? М.Ю.Лермонтов. 8 Б класс Патент № 2213311. Индукционная тигельная печь-термос
Патент № 2213311. Индукционная тигельная печь-термос Материя, движение, взаимодействие
Материя, движение, взаимодействие Музей-заповедник усадьба Абрамцево
Музей-заповедник усадьба Абрамцево Балочная плита перекрытия, многопролетная неразрезная балка. Расчетная схема
Балочная плита перекрытия, многопролетная неразрезная балка. Расчетная схема Базовые перинатальные матрицы Станислава Грофа
Базовые перинатальные матрицы Станислава Грофа Предмет органической химии
Предмет органической химии Фенилхромановые соединения. Флавоноиды
Фенилхромановые соединения. Флавоноиды Российская империя в XVIII веке. Эпоха дворцовых переворотов 1725-1762
Российская империя в XVIII веке. Эпоха дворцовых переворотов 1725-1762 Человек: информация и информационные процессы
Человек: информация и информационные процессы Копия татарское искусство
Копия татарское искусство Разминка перед тренировкой. Комплекс упражнений для подготовки тела к физической нагрузке
Разминка перед тренировкой. Комплекс упражнений для подготовки тела к физической нагрузке Опоры ЛЭП
Опоры ЛЭП Нормативно-правовое обеспечение деятельности временных детских разновозрастных коллективов
Нормативно-правовое обеспечение деятельности временных детских разновозрастных коллективов Схема станции М
Схема станции М Проектирование цифровых устройств на ПЛИС
Проектирование цифровых устройств на ПЛИС Технологические процессы заготовки кормов
Технологические процессы заготовки кормов шаблон для презентаций Лотос и Яблоневый цвет
шаблон для презентаций Лотос и Яблоневый цвет Empirical Legal Research
Empirical Legal Research Электромеханические элементы релейной защиты
Электромеханические элементы релейной защиты Международные стандарты ISO серии 9000
Международные стандарты ISO серии 9000 Цифровая схемотехника. Счетчики. (Лекция 11)
Цифровая схемотехника. Счетчики. (Лекция 11) Снятие мерок с фигуры человека
Снятие мерок с фигуры человека Народная кукла-оберег. Травница.
Народная кукла-оберег. Травница. Учебно-методические комплексы (УМК) для начальной школы
Учебно-методические комплексы (УМК) для начальной школы Русско-ордынские отношения
Русско-ордынские отношения Рекреационная география. Рекреация, как социально-экономическое явление. (Лекция 2)
Рекреационная география. Рекреация, как социально-экономическое явление. (Лекция 2)