Содержание
- 2. Цели урока: 1.Сформулировать основные положения теории электролитической диссоциации. 2.Закрепить понятия: ион, катион, анион, Гидратированные и Негидратированные
- 3. План урока: 1. Организационный момент. Проверка домашнего задания. 2.Разбор нового материала: А)основные положения теории ЭД. Б)
- 4. 1.Проверка домашнего задания (опрос по вопросам). 1. Что такое электролиты и не электролиты? 2. Электролитическая диссоциация,
- 5. 3.С каким типом связи характерны этапы растворения веществ: А. 1)ориентация молекул 2)гидратация молекул 3)диссоциация кристалла электролита.
- 6. Процесс распада электролитов на заряженные частицы ─ ионы называют электролитической диссоциацией («dissociation» ─ разобщение). Основные положения
- 7. Основные положения теории электролитической диссоциации: 1.Положение теории. При растворении в воде электролиты диссоциируют (распадаются) на положительные
- 8. Ионы бывают: Простыми: Na+; Fe2+; Cl - и т.д. Назовите еще простые ионы. Сложными: SO4; NO3;
- 9. 2.Положение теории. Причиной диссоциации электролита в водном растворе является его гидратация, т.е. взаимодействие электролита с молекулами
- 10. Гидратированные ионы – в растворах и кристаллогидратах. Негидратированные ионы – безводные соли. Свойства гидратированных и негидратированных
- 11. 3.Положение теории. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока –
- 12. Схема прибора для определения электропроводности раствора: 1 - источник тока; 2 - гальванометр или лампочка; 3
- 13. 4.Положение теории. Электролитическая диссоциация – процесс обратимый для слабых электролитов. Процесс ассоциации – обратный процесс диссоциации.
- 14. 5.Положение теории. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы
- 15. При погружении электродов в дистиллированную воду лампочка не загорается. Чистая вода не проводит электрический ток.
- 16. Не проводит ток и сухая поваренная соль NaCl , если в нее погрузить электроды.
- 17. А вот водный раствор этой же соли проводит электрический ток. Точно так же ведут себя и
- 18. 6.Положение теории. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. /Диссоциация
- 19. Диссоциация кислот. HNO3 ↔H ++NO3- Многоосновные кислоты. I. H2SO4_= H+ + HSO4_ II. HSO4_↔H ++ SO42-
- 20. Диссоциация оснований. КОН ↔К ++ОН – Многоосновные основания. I. Ва(ОН) 2 = ВаОН + + ОН
- 21. Диссоциация солей. ZnSO4 = Zn 2+ + SO42- Al 2(SO4)3=2Al 3++3SO42- NaCl = Na + +
- 22. Закрепление. Что такое анион? Что такое катион? Чем отличаются катионы и анионы? Что такое катод и
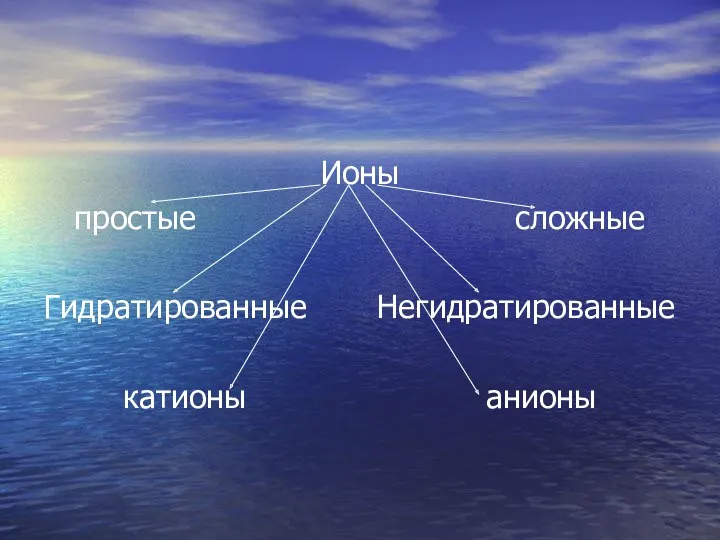
- 23. Закончите схему. Ионы
- 24. Ионы простые сложные Гидратированные Негидратированные катионы анионы
- 26. Скачать презентацию






















 20230419_predmet_himii
20230419_predmet_himii Выполнение работ по одной или нескольким профессиям рабочих, должностям служащих
Выполнение работ по одной или нескольким профессиям рабочих, должностям служащих Использование Су-Джок терапии - при коррекции речевых нарушений
Использование Су-Джок терапии - при коррекции речевых нарушений Просечной металл. Приемы изготовления просечного металла
Просечной металл. Приемы изготовления просечного металла Как проектировать парк. 7 шагов к созданию хорошей зеленой территории
Как проектировать парк. 7 шагов к созданию хорошей зеленой территории Валя Котик
Валя Котик Презентация по теме США 11 класс
Презентация по теме США 11 класс Волго-Вятский район
Волго-Вятский район Развитие выносливости у подростков 13-14 лет в школьной секции общей физической подготовки
Развитие выносливости у подростков 13-14 лет в школьной секции общей физической подготовки урок по ППД
урок по ППД электронное портфолио
электронное портфолио Система NTSC
Система NTSC Школьные правила в стихах.
Школьные правила в стихах. Презентация Развитие российско-китайских отношений в 17-сер. 19 вв.
Презентация Развитие российско-китайских отношений в 17-сер. 19 вв. Социальные взаимодействия
Социальные взаимодействия Что такое информация
Что такое информация Клиникалық жағдай. Anamnesis morbi
Клиникалық жағдай. Anamnesis morbi Шаблоны презентаций Художники
Шаблоны презентаций Художники Облицовка вертикальной поверхности и короба керамической плиткой способом шов в шов
Облицовка вертикальной поверхности и короба керамической плиткой способом шов в шов Лимфогранулематоз кишечника
Лимфогранулематоз кишечника Советская автопромышленность
Советская автопромышленность Перемещение товаров и транспортных средств через таможенную границу
Перемещение товаров и транспортных средств через таможенную границу Догмат о Церкви Христова (часть 2)
Догмат о Церкви Христова (часть 2) Возможности использования дидактических игр для реализации регионального компонента
Возможности использования дидактических игр для реализации регионального компонента Электролиз
Электролиз Космоквантум. Родительское собрание
Космоквантум. Родительское собрание The Present Simple Tense
The Present Simple Tense Успешные продажи: главное — понять потребности покупателя
Успешные продажи: главное — понять потребности покупателя