Содержание
- 2. Спирты
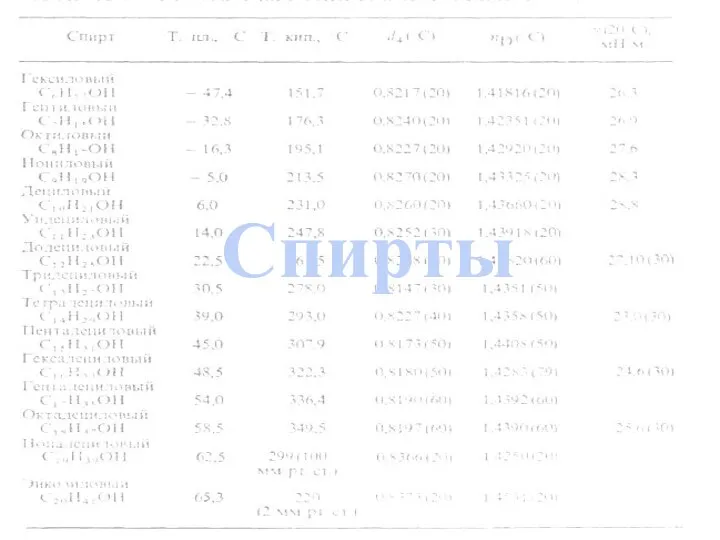
- 3. Одноатомные спирты Номенклатура Получение Физические свойства Гомология Строение Применение Изомерия Химические свойства Многоатомные спирты Автор
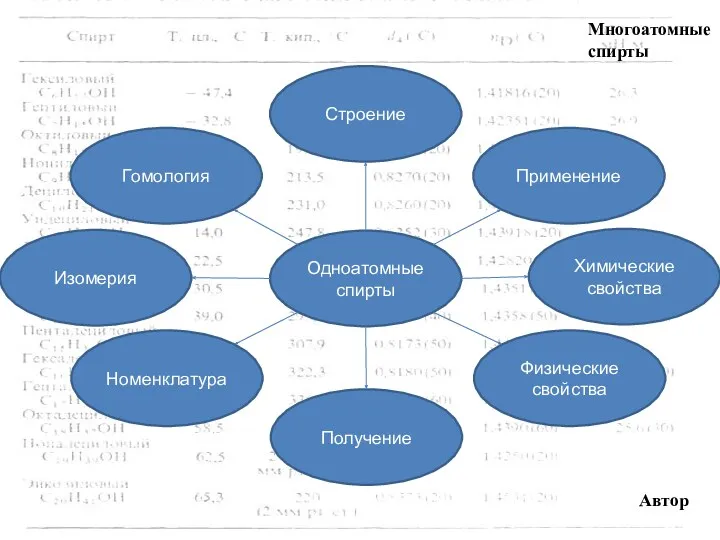
- 4. Многоатомные спирты Получение Номенклатура Получение Физические свойства Строение Применение Изомерия Химические свойства Одноатомные спирты Автор
- 5. Одноатомные спирты — органические соединения, содержащие одну гидроксильную группу (групп −OH), связанных с углеводородным радикалом. Формула:
- 6. Общая формула веществ гомологического ряда предельных одноатомных спиртов: R-ОН. Гомология
- 7. Начиная с третьего члена гомологического ряда у спиртов появляется изомерия положения функциональной группы, а с четвертого
- 8. При образовании названий спиртов к названию углеводорода добавляют суффикс- ол. Цифрами после суффикса указывают положение гидроксильной
- 9. Реакции окисления — основаны на окислении углеводородов (реже — галогенпроизводных углеводородов), содержащих кратные или активированные C−H
- 10. Спирты, содержащие от одного до одиннадцати атомов углерода в молекуле-жидкости, от двенадцати атомов в молекуле -твердые
- 11. Химические свойства спиртов различны и зависят от углеводородных радикалов Спирты взаимодействуют с щелочными и щелочноземельными металлами,
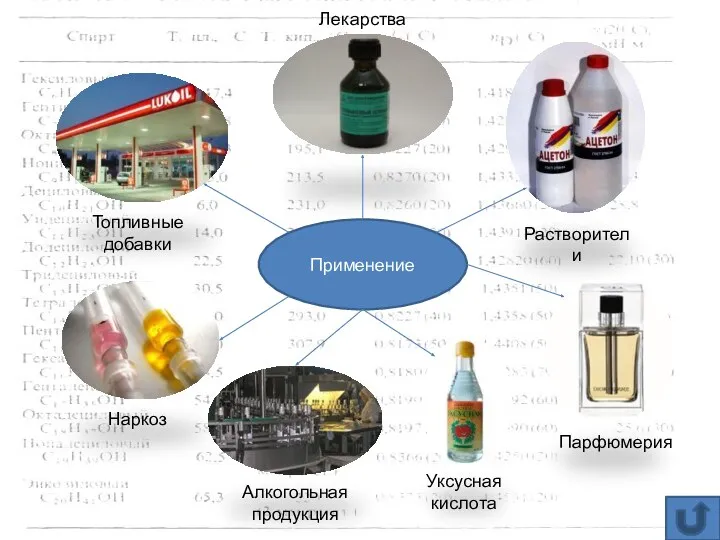
- 12. Применение Топливные добавки Лекарства Растворители Наркоз Алкогольная продукция Уксусная кислота Парфюмерия
- 13. Одноатомные спирты — органические соединения, содержащие две или более гидроксильных групп (групп −OH), связанных с углеводородным
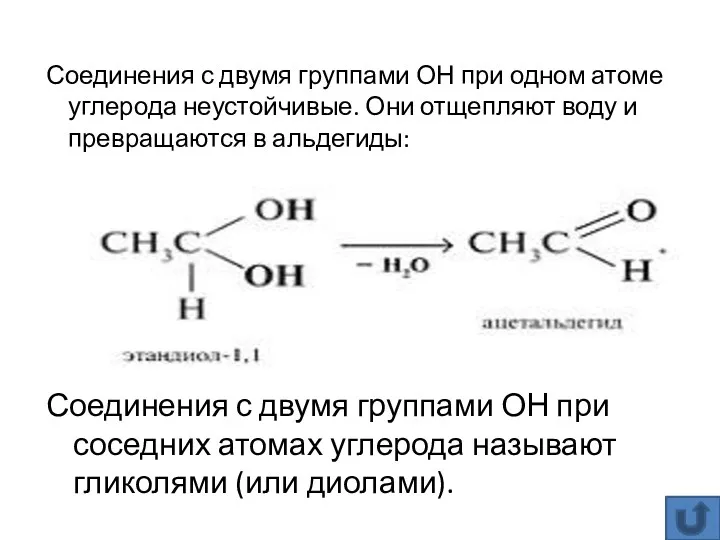
- 14. Соединения с двумя группами ОН при соседних атомах углерода называют гликолями (или диолами). Соединения с двумя
- 15. Начиная с третьего члена гомологического ряда у спиртов появляется изомерия положения функциональной группы, а с четвертого
- 16. При образовании названий спиртов к названию углеводорода добавляют суффикс- ол. Цифрами после суффикса указывают положение гидроксильной
- 17. Получение Гликоли получают окислением алкенов в водной среде. Например, при действии перманганата калия или кислорода воздуха
- 18. Другой способ получения многоатомных спиртов – гидролиз галогенпроизводных углеводородов:
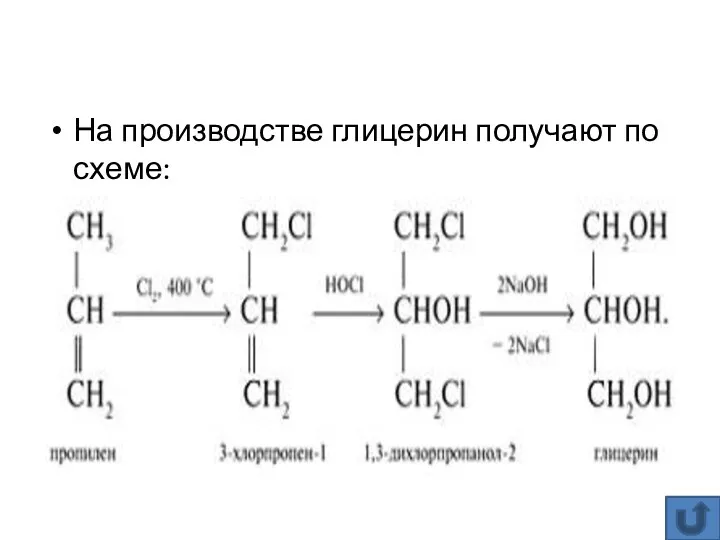
- 19. На производстве глицерин получают по схеме:
- 20. Физические свойства Этиленгликоль и глицерин – бесцветные вязкие жидкости со сладким вкусом (от греч. – сладкий).
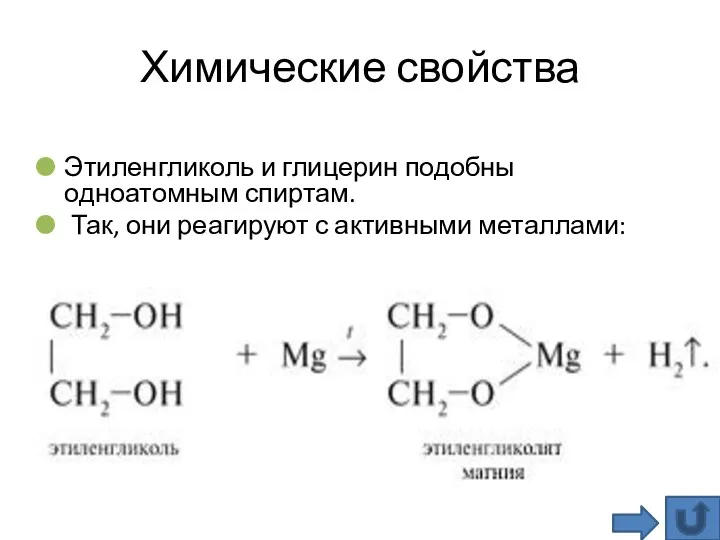
- 21. Химические свойства Этиленгликоль и глицерин подобны одноатомным спиртам. Так, они реагируют с активными металлами:
- 22. Многоатомные спирты в реакции с галогеноводородами обменивают одну или несколько гидроксильных групп ОН на атомы галогена:
- 23. Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения
- 24. Качественная реакция многоатомных спиртов, позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В
- 26. Скачать презентацию
















 Презентация Добродетель и порок
Презентация Добродетель и порок Биологические аспекты действия ионизирующих излучений на организмы
Биологические аспекты действия ионизирующих излучений на организмы Наши будни
Наши будни Адаптация ребенка в ДОУ
Адаптация ребенка в ДОУ Орлы - хищные птицы отряда соколообразных
Орлы - хищные птицы отряда соколообразных Проектирование, освоение и введение севооборотов в земледелии. Агротехническая и экономическая их оценка. (Лекция 4)
Проектирование, освоение и введение севооборотов в земледелии. Агротехническая и экономическая их оценка. (Лекция 4) Өй эшләрен тикшерү. “Бөтен тигезләмәләрне график юл белән чишү
Өй эшләрен тикшерү. “Бөтен тигезләмәләрне график юл белән чишү Трёхобмоточные трансформаторы. Лекция 10
Трёхобмоточные трансформаторы. Лекция 10 ევროპა
ევროპა Микроконтроллеры и ПЛИС. Пример создания программы
Микроконтроллеры и ПЛИС. Пример создания программы Иммунные заболевания. Аллергии. История алергии
Иммунные заболевания. Аллергии. История алергии ЭКГ при гипертрофии миокарда
ЭКГ при гипертрофии миокарда ВКНС. Основания.
ВКНС. Основания. Исследовательская работа: Мой славный предок
Исследовательская работа: Мой славный предок Fifty States of America
Fifty States of America История политических учений
История политических учений Проектирование. Функциональность морских платформ
Проектирование. Функциональность морских платформ Теории управления персоналом
Теории управления персоналом Энергосбережение и энергоаудит на промышленных предприятиях
Энергосбережение и энергоаудит на промышленных предприятиях Особенности производства сыров из козьего молока
Особенности производства сыров из козьего молока
 Презентация к уроку по теме: Обобщение и систематизация знаний по темеВода.Растворы.Основания
Презентация к уроку по теме: Обобщение и систематизация знаний по темеВода.Растворы.Основания Знакомство с дорожными знаками Диск
Знакомство с дорожными знаками Диск Современные образовательные технологии в учреждении дополнительного образования
Современные образовательные технологии в учреждении дополнительного образования Домашние животные
Домашние животные Эконометрика. Модели обработки остатков ARMA. Лаговые модели
Эконометрика. Модели обработки остатков ARMA. Лаговые модели Разновидности графики
Разновидности графики Единый орфографический режим в начальной школе (математика)
Единый орфографический режим в начальной школе (математика)