Содержание
- 2. Открытию периодического закона предшествовало накопление знаний о веществах и свойствах. По мере открытия новых химических элементов,
- 3. В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных
- 4. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал периодический закон, который в начальной
- 5. Уязвимым моментом периодического закона сразу после его открытия было объяснение причины периодического повторения свойств элементов с
- 6. Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что
- 7. Открытый Д. И. Менделеевым закон и построенная на основе закона периодическая система элементов - это важнейшее
- 8. Периоды - горизонтальные ряды химических элементов, всего 7 периодов. Периоды делятся на малые (I,II,III) и большие
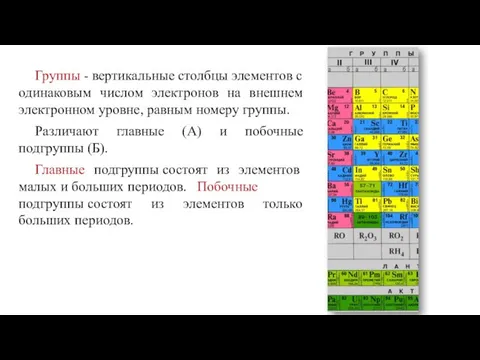
- 9. Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне, равным номеру группы.
- 10. Поскольку окислительно – восстановительные свойства атомов оказывают влияние на свойства простых веществ и их соединений, то
- 11. Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в главных подгруппах возрастают, в периодах
- 12. Электроотрицательность в периоде увеличивается с возрастанием заряда ядра химического элемента, то есть слева направо. В группе
- 13. Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к. притяжение ядром электронных оболочек усиливается.
- 14. В одной и той же группе с увеличением номера периода атомные радиусы возрастают. Атомы металлов сравнительно
- 16. Скачать презентацию












 Родина моя - Россия
Родина моя - Россия Зір тварин
Зір тварин Агентство маркетинговых исследований
Агентство маркетинговых исследований Лучше друга в тундре нет (к уроку Культура народов Ямала)
Лучше друга в тундре нет (к уроку Культура народов Ямала) ООО Аптека Исцеление
ООО Аптека Исцеление Педагогическое общение
Педагогическое общение Всенощное бдение. Великая вечерня (окончание)
Всенощное бдение. Великая вечерня (окончание) Future Tenses
Future Tenses ВКР: Электрификация и автоматизация технологических процессов при строительстве станции Улица Новаторов
ВКР: Электрификация и автоматизация технологических процессов при строительстве станции Улица Новаторов Роман А.С.Пушкина Евгений Онегин
Роман А.С.Пушкина Евгений Онегин Сбор и хранение медицинских отходов
Сбор и хранение медицинских отходов Респираторно - синцитиальная инфекция
Респираторно - синцитиальная инфекция Дамудың қатерлі кезеңдері
Дамудың қатерлі кезеңдері Эффективность и справедливость в бюджетных расходах. Фискальный федерализм
Эффективность и справедливость в бюджетных расходах. Фискальный федерализм Возрастные особенности онтогенеза
Возрастные особенности онтогенеза Бюджетный федерализм
Бюджетный федерализм Театральный словарь
Театральный словарь Формирователь сигналов непрерывного канала многозначной системы автоматической локомотивной сигнализации
Формирователь сигналов непрерывного канала многозначной системы автоматической локомотивной сигнализации Группа в социальном пространстве. Признаки и функции коллектива, методика его формирования
Группа в социальном пространстве. Признаки и функции коллектива, методика его формирования Промежуточный мозг
Промежуточный мозг Химические реакции
Химические реакции تابع الفصل الثالث برنامج العروض التقديمية
تابع الفصل الثالث برنامج العروض التقديمية Адаптивная физическая культура и ее значение в коррекции нарушений у детей с ограниченными возможностями здоровья
Адаптивная физическая культура и ее значение в коррекции нарушений у детей с ограниченными возможностями здоровья Презентация MsPP Дни воинской славы России, часть 1
Презентация MsPP Дни воинской славы России, часть 1 Ф.А.Искандер - советский и российский прозаик и абхазский поэт
Ф.А.Искандер - советский и российский прозаик и абхазский поэт Мультимедийная презентация по реализации задач образовательной области Здоровье
Мультимедийная презентация по реализации задач образовательной области Здоровье Жизнелюбие и отношения полов
Жизнелюбие и отношения полов Подготовка масличного сырья к извлечению. Прессование
Подготовка масличного сырья к извлечению. Прессование