Содержание
- 2. Общая характеристика элементов главной подгруппы II группы У в е л и ч и в а
- 3. Ве - амфотерный металл, Mg – металл, Сa, Sr,Ba - щёлочноземельные металлы Ra –радиоактивный элемент
- 4. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют СО +2
- 5. Be – светло-серый, твердый, хрупкий Ca – твердый, пластичный Mg – относительно мягкий, пластичный, ковкий Sr
- 7. Химические свойства элементов II группы главной подгруппы
- 8. Химические свойства оксидов BeO – амфотерный оксид MgO CaO SrO Основные оксиды BaO Оксид кальция СаО
- 9. Химические свойства гидроксидов Ве(ОН)2 – амфотерный гидроксид Mg(OH)2 – нерастворимое основание Ca(OH)2 Sr(OH)2 Ba(OH)2 Растворимые основания
- 12. Напишите уравнения реакций с помощью которых можно осуществить превращения: Са(ОН)2 ←Са→СаО→Са(ОН)2→Са(NO3)2→CaSO4 Be→BeO→BeCl2→Be(OH)2→Na2BeO2 ↓ BeSO4
- 14. Скачать презентацию











 Шаблоны для презентаций - 2
Шаблоны для презентаций - 2 Как избавиться от зависимости или 12 шагов к Богу
Как избавиться от зависимости или 12 шагов к Богу Литературная классика XX века. Полюсы добра и зла
Литературная классика XX века. Полюсы добра и зла Серебряный век. Кинематограф
Серебряный век. Кинематограф Повышение экономической эффективности деятельности ООО Киноцентр Вологда
Повышение экономической эффективности деятельности ООО Киноцентр Вологда Инженерный менеджмент и информационные технологии. (Лекция 1)
Инженерный менеджмент и информационные технологии. (Лекция 1) Соединение деталей вполдерева
Соединение деталей вполдерева Классный час Знай правила движения, как таблицу умножения
Классный час Знай правила движения, как таблицу умножения Традиционные и нетрадиционные направления в искусстве в конце 19 - начале 20в
Традиционные и нетрадиционные направления в искусстве в конце 19 - начале 20в Презентации для занятий кружка Умники и умницы
Презентации для занятий кружка Умники и умницы Updated_Prezentatsia (1)
Updated_Prezentatsia (1) Цветы в саду
Цветы в саду Система мониторинга и защиты мобильных и стационарных объектов Алмаз. Настройка и монтаж терминальных устройств серии Титан
Система мониторинга и защиты мобильных и стационарных объектов Алмаз. Настройка и монтаж терминальных устройств серии Титан Что такое звукоряд. От весны и до весны. Какого цвета лето?
Что такое звукоряд. От весны и до весны. Какого цвета лето? фотошоп итг
фотошоп итг Present simple tense
Present simple tense Конвенция о правах ребёнка Диск
Конвенция о правах ребёнка Диск Тест по ПДД. 1-4 класс
Тест по ПДД. 1-4 класс Есептеуіш техниканың даму келешегі
Есептеуіш техниканың даму келешегі Гласный звук [э]. Буквы Э, э
Гласный звук [э]. Буквы Э, э Basic rules of the articles
Basic rules of the articles Republic of Poland
Republic of Poland Русь Православная. Храмы России.
Русь Православная. Храмы России. Презентация-отчет о празднике В гостях у сказки
Презентация-отчет о празднике В гостях у сказки Семейные традиции.
Семейные традиции.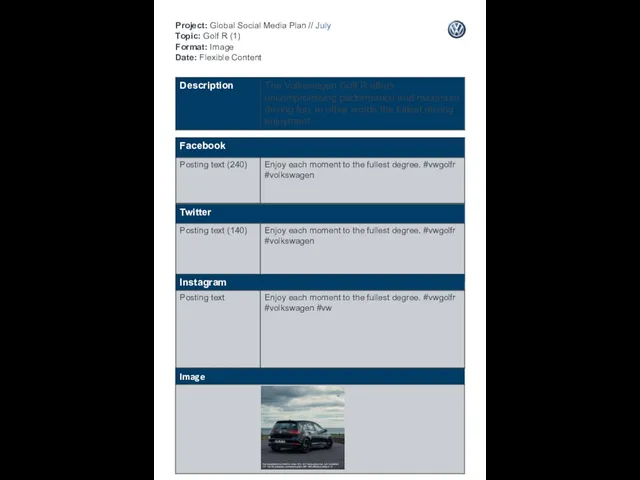 Project: Global Social Media Plan // July Topic: Golf R (1) Format: Image Date: Flexible Content
Project: Global Social Media Plan // July Topic: Golf R (1) Format: Image Date: Flexible Content Вода. Какая она? Тест. Часть 2
Вода. Какая она? Тест. Часть 2 Клітинний кворум
Клітинний кворум