Содержание
- 2. ФИЗИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВ Якоб Вант-Гофф Сванте Аррениус Вильгельм Освальд 1887 год Растворение--результат диффузии, т.е. физический процесс.
- 3. Физико-химическая теория растворов. 1906год Д.И.Менделеев Гидратная теория растворов. При взаимодействии растворённого вещества с водой образуются гидраты.
- 4. опыт 1 В пробирку поместите белые кристаллы CuSO4, добавьте воды, перемешайте. Определите цвет полученного раствора. CuSO4
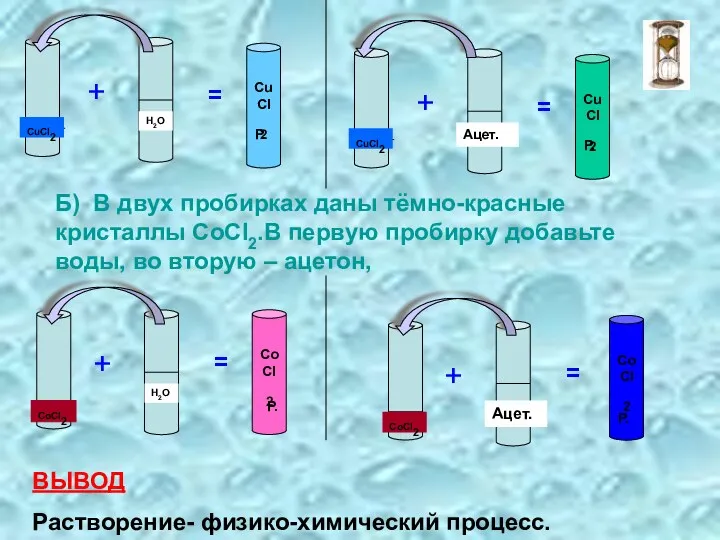
- 5. Б) В двух пробирках даны тёмно-красные кристаллы СоСI2.В первую пробирку добавьте воды, во вторую – ацетон,
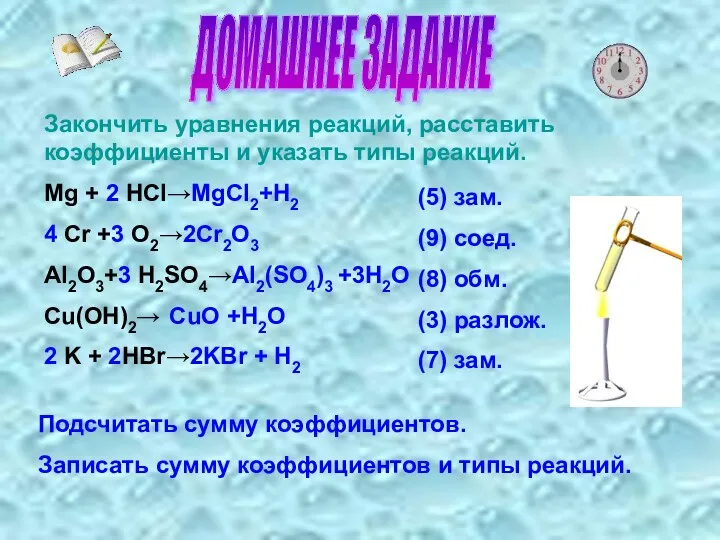
- 6. ДОМАШНЕЕ ЗАДАНИЕ Закончить уравнения реакций, расставить коэффициенты и указать типы реакций. Mg + 2 HCI→MgCI2+H2 4
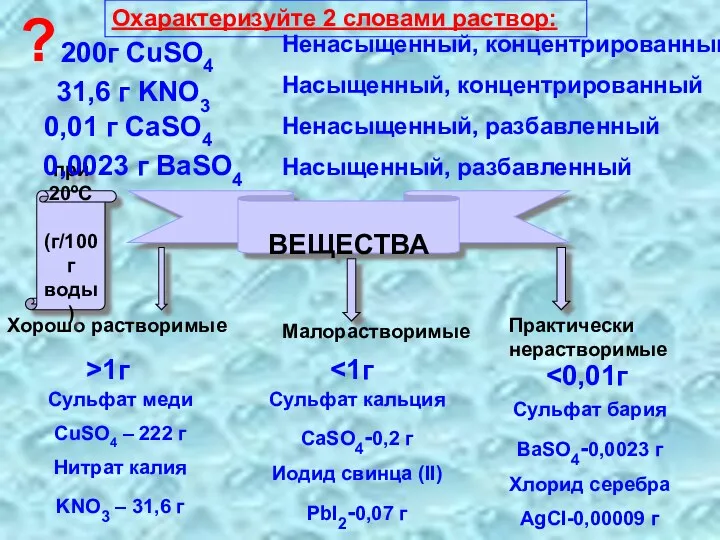
- 7. РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ при 20ºС (г/100г воды) Хорошо растворимые Малорастворимые Практически нерастворимые >1г Сульфат меди
- 8. ЗАДАЧА В организме человека в среднем содержится 5 л крови, плотность которой состовляет 1,05 г/мл. Сколько
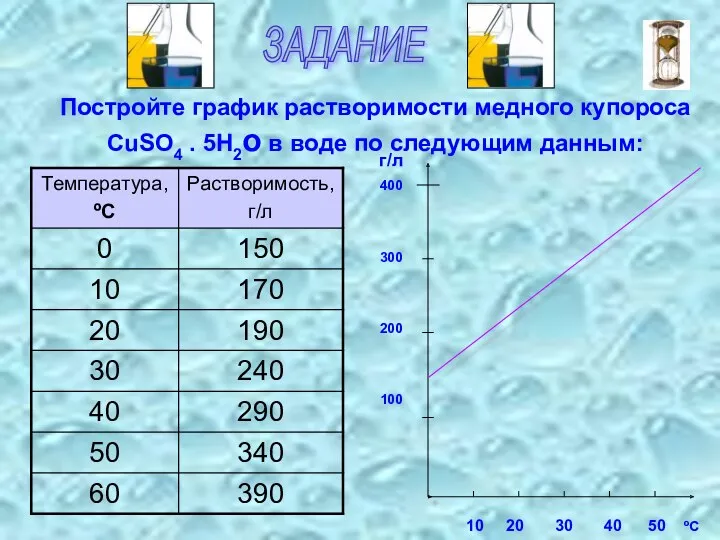
- 9. ЗАДАНИЕ Постройте график растворимости медного купороса CuSO4 . 5H2о в воде по следующим данным: 10 20
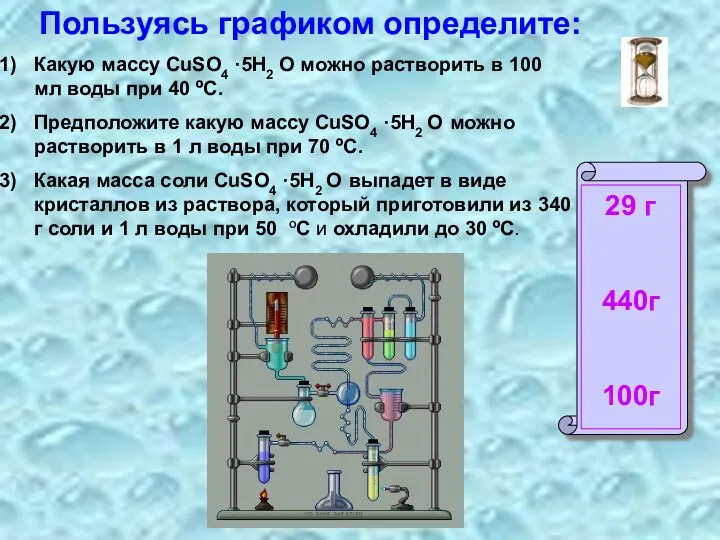
- 10. Пользуясь графиком определите: Какую массу CuSO4 ·5H2 O можно растворить в 100 мл воды при 40
- 11. ОТВЕТ: m(гем.) = 630 г m(Fe) = 31,5 г.
- 12. ТИПЫ РАСТВОРОВ
- 13. ВЕЩЕСТВА Хорошо растворимые Малорастворимые Практически нерастворимые >1г Сульфат меди CuSO4 – 222 г Нитрат калия KNO3
- 15. КРОССВОРД O2
- 16. ДОМАШНЕЕ ЗАДАНИЕ § 34 Упражнения 4, 5, 6. Страница 142 ДОМАШНЕЕ ЗАДАНИЕ ДОМАШНЕЕ ЗАДАНИЕ § 34
- 18. Скачать презентацию










 Сестринский процесс при хроническом энтероколите
Сестринский процесс при хроническом энтероколите Методы синтеза и анализа цифровых фильтров. Введение
Методы синтеза и анализа цифровых фильтров. Введение Systemy transportowe – transport globalny
Systemy transportowe – transport globalny Колонизация Сибири русским народом
Колонизация Сибири русским народом Дедуктивные выводы из сложных суждений. Логика
Дедуктивные выводы из сложных суждений. Логика Михаил Васильевич Ломоносов
Михаил Васильевич Ломоносов Вербальная модель в сервисе
Вербальная модель в сервисе Глаз, как оптическая система
Глаз, как оптическая система 2015.03.20.Open house.Odesa.Application
2015.03.20.Open house.Odesa.Application Паровой двигатель
Паровой двигатель Организация объединенных наций (ООН)
Организация объединенных наций (ООН) Пластиковый Апокалипсис
Пластиковый Апокалипсис Развитие коммуникативных игр
Развитие коммуникативных игр Мини Мастер конструктор керамический Печь для итальянской пиццы, как настоящий, 1 : 10
Мини Мастер конструктор керамический Печь для итальянской пиццы, как настоящий, 1 : 10 Литосфера. Основные особенности литосферы. Влияние деятельности человека
Литосфера. Основные особенности литосферы. Влияние деятельности человека Дикорастущие плодовые и орехоплодные растения разных типов леса, их запасы и заготовка
Дикорастущие плодовые и орехоплодные растения разных типов леса, их запасы и заготовка Стипендия. Виды стипендий
Стипендия. Виды стипендий Классификация извещателей пожарных (ИП)
Классификация извещателей пожарных (ИП) Манометры и гидравлическое оборудование
Манометры и гидравлическое оборудование Презентация Стихийные бедствия 2 часть
Презентация Стихийные бедствия 2 часть Числа 3 и 8 (1 класс)
Числа 3 и 8 (1 класс) Увольнение с военной службы
Увольнение с военной службы Интерактивный тренажер Процент от числа
Интерактивный тренажер Процент от числа Материалы и изделия из древесины. Тема 2
Материалы и изделия из древесины. Тема 2 Кишечный шов
Кишечный шов Мотивация учения- основное условие успешного обучения Выступление на педсовете
Мотивация учения- основное условие успешного обучения Выступление на педсовете Салтыков – Щедрин История одного города
Салтыков – Щедрин История одного города Строительство высокоскоростной магистрали ВСМ-2 Москва-Казань
Строительство высокоскоростной магистрали ВСМ-2 Москва-Казань