Содержание
- 2. Двойственная природа электрона Электрон имеет массу и заряд, как частица. Электрон проявляет волновые свойства – способен
- 3. Электрон в атоме может находиться в любой точке пространства вокруг ядра, однако вероятность его пребывания в
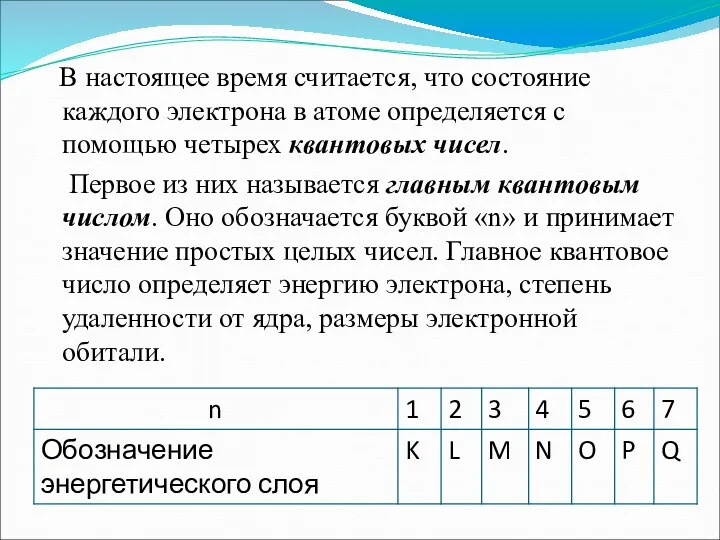
- 4. В настоящее время считается, что состояние каждого электрона в атоме определяется с помощью четырех квантовых чисел.
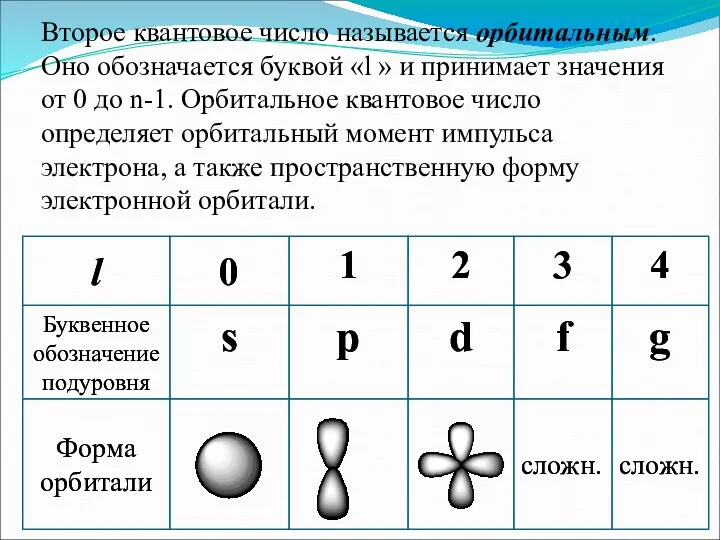
- 5. Второе квантовое число называется орбитальным. Оно обозначается буквой «l » и принимает значения от 0 до
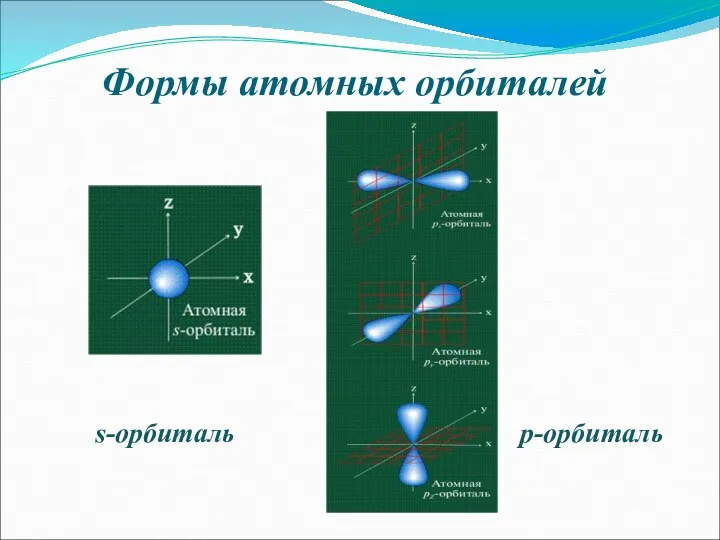
- 6. Формы атомных орбиталей s-орбиталь p-орбиталь
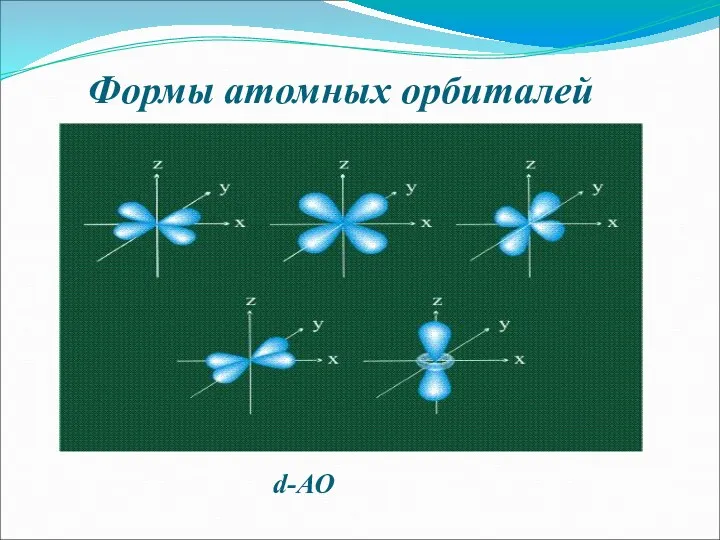
- 7. Формы атомных орбиталей d-АО
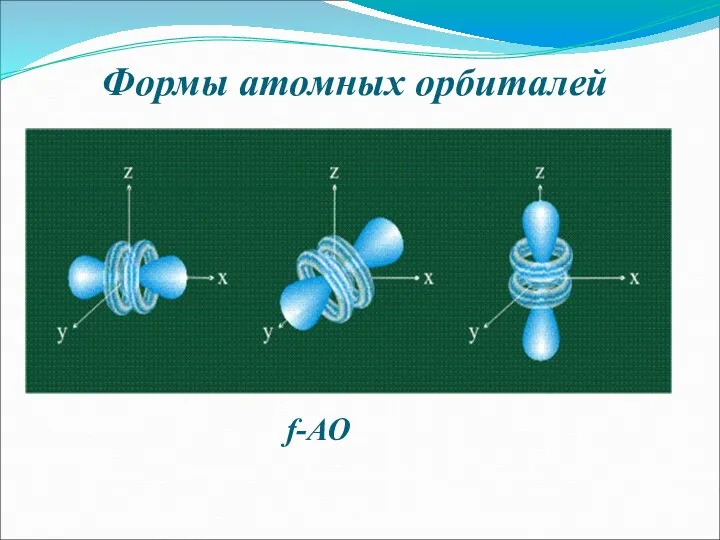
- 8. Формы атомных орбиталей f-АО
- 9. Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Энергетический подуровень – это совокупность электронных
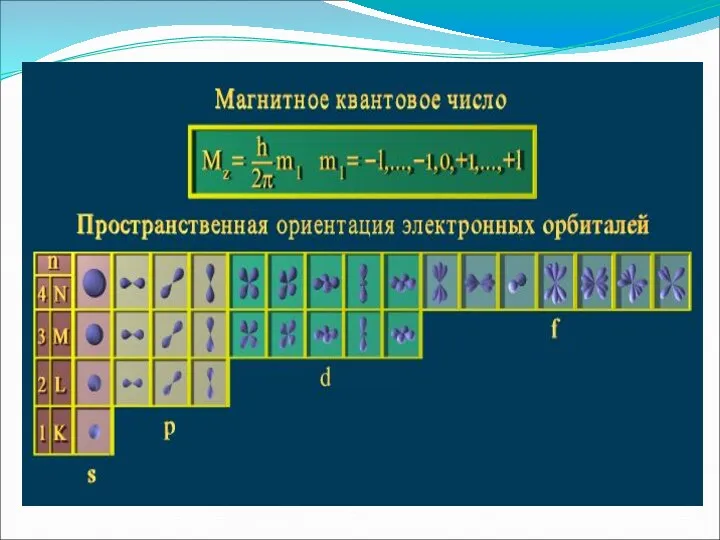
- 10. Магнитное квантовое число ml определяет значения проекции орбитального момента на одной из осей, а также пространственную
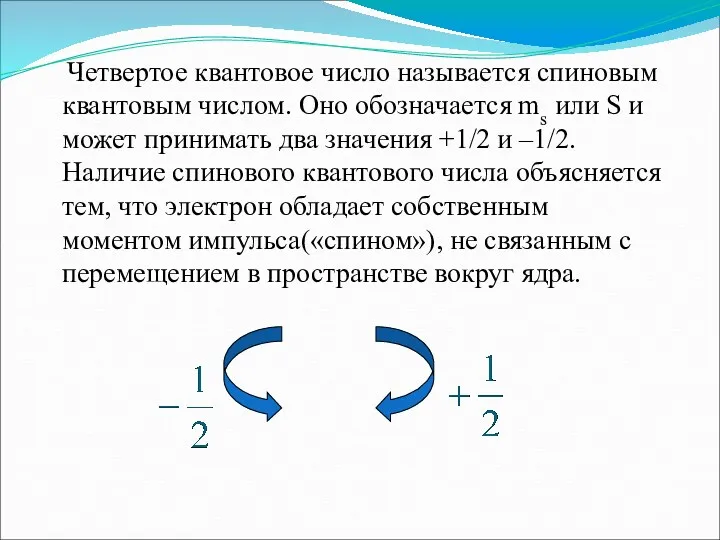
- 12. Четвертое квантовое число называется спиновым квантовым числом. Оно обозначается ms или S и может принимать два
- 13. Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в атоме не может быть двух
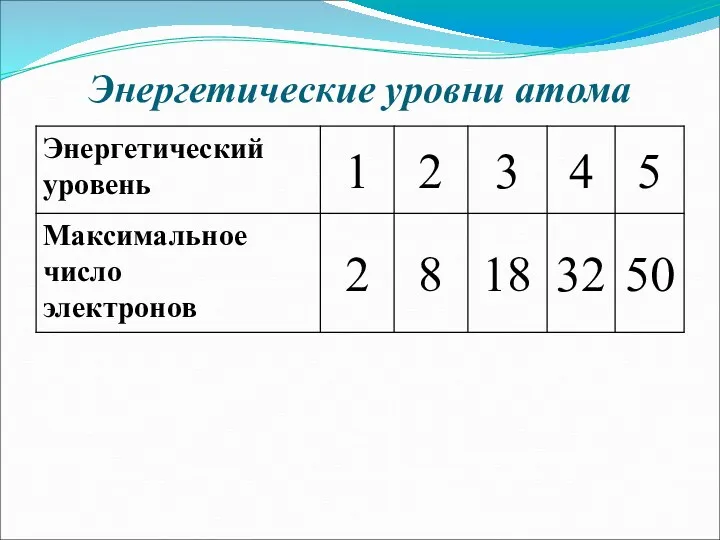
- 14. Энергетические уровни атома
- 16. Скачать презентацию





 Основные организационные направления в работе с одаренными детьми на 2017-2018 учебный год
Основные организационные направления в работе с одаренными детьми на 2017-2018 учебный год delovaya_igra_dlya_pedagogov
delovaya_igra_dlya_pedagogov Классный час о дружбе
Классный час о дружбе История развития предмета экология человека
История развития предмета экология человека Психологическая готовность к школе
Психологическая готовность к школе Вокально-интонационные упражнения
Вокально-интонационные упражнения Лесная промышленность России
Лесная промышленность России Самопрезентация
Самопрезентация Развитие мелкой моторики и речи у детей старшего дошкольного возраста
Развитие мелкой моторики и речи у детей старшего дошкольного возраста Презентация к лексико-грамматическому занятию Домашние животные
Презентация к лексико-грамматическому занятию Домашние животные Презентация 8 марта - Международный женский день
Презентация 8 марта - Международный женский день Мировая энергетика. Источники энергии. Энергетический баланс в мире. (Тема 19)
Мировая энергетика. Источники энергии. Энергетический баланс в мире. (Тема 19) Адаптация пятиклассников к новым условиям обучения
Адаптация пятиклассников к новым условиям обучения Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии СССР во второй половине 1950 - начале 1980-х гг
СССР во второй половине 1950 - начале 1980-х гг родительское собрание в 5 классе или в конце 4 класса по адаптации
родительское собрание в 5 классе или в конце 4 класса по адаптации Педагогическое общение. Конфликты в педагогическом общении и их преодоление
Педагогическое общение. Конфликты в педагогическом общении и их преодоление Восточное направление внешней политики Ивана IV Грозного
Восточное направление внешней политики Ивана IV Грозного Постановка звука [Ц]
Постановка звука [Ц] Саморегулируемые организации кадастровых инженеров
Саморегулируемые организации кадастровых инженеров Мое рабочее место – лаборатория творчества
Мое рабочее место – лаборатория творчества 课件制作者 张莉
课件制作者 张莉 История Трои
История Трои Производство муки
Производство муки Буддизм – самая древняя мировая религия
Буддизм – самая древняя мировая религия Книги по английскому языку в помощь учебному процессу. База Юрайт
Книги по английскому языку в помощь учебному процессу. База Юрайт Василь Стефаник
Василь Стефаник Шаруашылық аумақтық ұйымдастырылуы. Ішкі айырмашылықтары
Шаруашылық аумақтық ұйымдастырылуы. Ішкі айырмашылықтары