Содержание
- 2. Цель урока: сформировать знания о процессе электролиза веществ, как окислительно-восстановительной реакции. Задачи урока: познакомиться с понятием
- 3. Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав
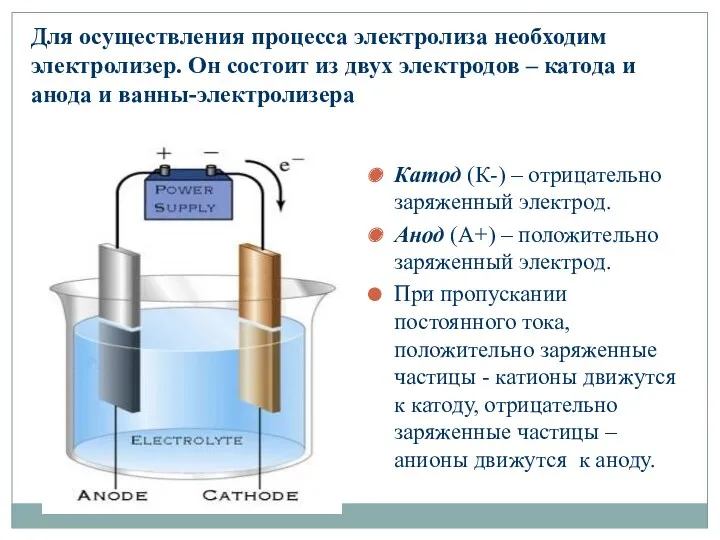
- 4. Для осуществления процесса электролиза необходим электролизер. Он состоит из двух электродов – катода и анода и
- 5. Процессы, протекающие на электродах ♦ Катод – это электрод, на поверхности которого избыток электронов, поэтому катионы
- 6. с инертными электродами (графитовые, угольные, платиновые), с активным анодом (растворимым, образованным металлами). Различают электролиз:
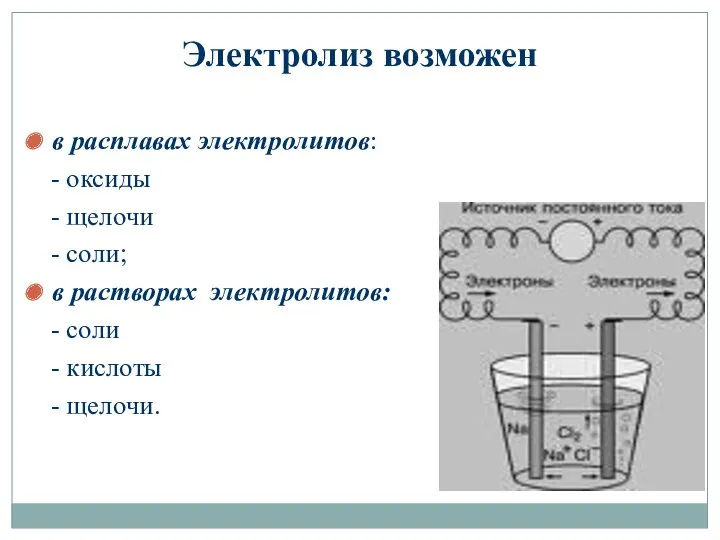
- 7. Электролиз возможен в расплавах электролитов: - оксиды - щелочи - соли; в растворах электролитов: - соли
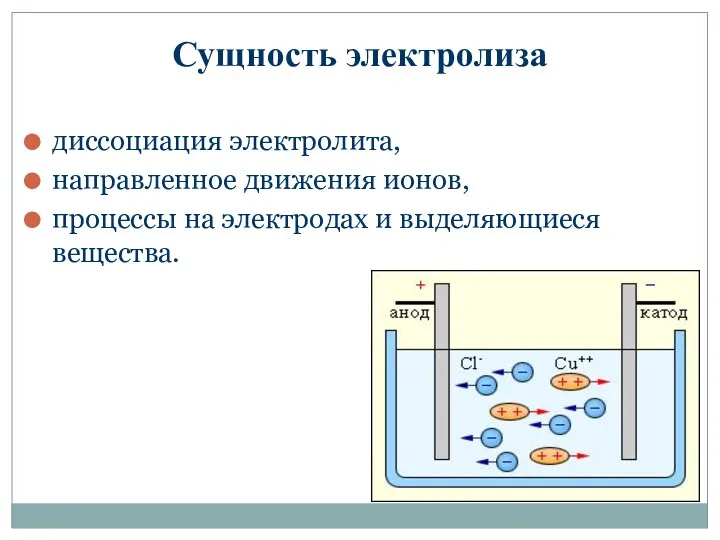
- 8. Сущность электролиза диссоциация электролита, направленное движения ионов, процессы на электродах и выделяющиеся вещества.
- 9. Электролиз расплава соли NaCl → Na+ + Cl- K(-): Na + + 1е- → Na0 |2
- 10. Электролиз расплава щелочи КОН → К+ + ОН- (К-): K+ + 1е- → К0 │4 (A+):
- 11. Электролиз расплава оксида Al2O3 → 2Al3+ + 3O2- (К-): Al3+ + 3е- → Al0 │ 4
- 12. Электролиз расплава кислородсодержащей соли Na2SO4 → 2Na+ + SO42- (К-): Na+ + 1е- → Na0 │4
- 14. Скачать презентацию








 Акция - Спасите ёжика!. ГБДОУ детский сад № 113 Выборгского района Санкт-Петербурга
Акция - Спасите ёжика!. ГБДОУ детский сад № 113 Выборгского района Санкт-Петербурга Христос - наша праведность (оправдание) и наше освящение. (Часть 3)
Христос - наша праведность (оправдание) и наше освящение. (Часть 3) Нетрадиционная техника рисования в детском саду
Нетрадиционная техника рисования в детском саду Presentation Ti
Presentation Ti Загородный поселок класса de luxe Гринфилд
Загородный поселок класса de luxe Гринфилд Математическая игра
Математическая игра Химические элементы. Формирование понятия.
Химические элементы. Формирование понятия. Я гражданин своей России
Я гражданин своей России Семья. Качества счастливой семьи
Семья. Качества счастливой семьи Развитие жизни на земле
Развитие жизни на земле Логоритмика
Логоритмика Основные показатели ремонтопригодности
Основные показатели ремонтопригодности Unit 4. Health
Unit 4. Health Кадак - церемониальный шарф
Кадак - церемониальный шарф Острое антропонозное заболевание холера
Острое антропонозное заболевание холера Использование отходов деревообрабатывающих производств
Использование отходов деревообрабатывающих производств Методика составления схем генератора с внешним возбуждением. Лекция 4
Методика составления схем генератора с внешним возбуждением. Лекция 4 Hangzhou dongya instrument CO, LTD
Hangzhou dongya instrument CO, LTD Презентация для воспитанников младшего возраста, мам и бабушек Женский день 8 Марта
Презентация для воспитанников младшего возраста, мам и бабушек Женский день 8 Марта Бамбергский Апокалипсис
Бамбергский Апокалипсис Сложение натуральных чисел и его свойства
Сложение натуральных чисел и его свойства Историко-социологический институт
Историко-социологический институт Сравнительная характеристика экосистем и агроэкосистем
Сравнительная характеристика экосистем и агроэкосистем Основы функционирования пищеварительного конвейера
Основы функционирования пищеварительного конвейера Классный час Моя малая Родина 1,3 классы.
Классный час Моя малая Родина 1,3 классы. Федеральное агентство по техническому регулированию и метрологии
Федеральное агентство по техническому регулированию и метрологии моя педагогическая концепция
моя педагогическая концепция Презентация для классного часа по теме Моя малая Родина
Презентация для классного часа по теме Моя малая Родина