Содержание
- 2. Шлифование поверхностей изделий На таких поверхностях не задерживается влага, лучше образуется защитная оксидная плёнка Поверхностный однороднее
- 3. «Ржа ест железо» - гласит русская народная пословица. «Коррозия – рыжая крыса, грызёт металлический лом.» Коррозия
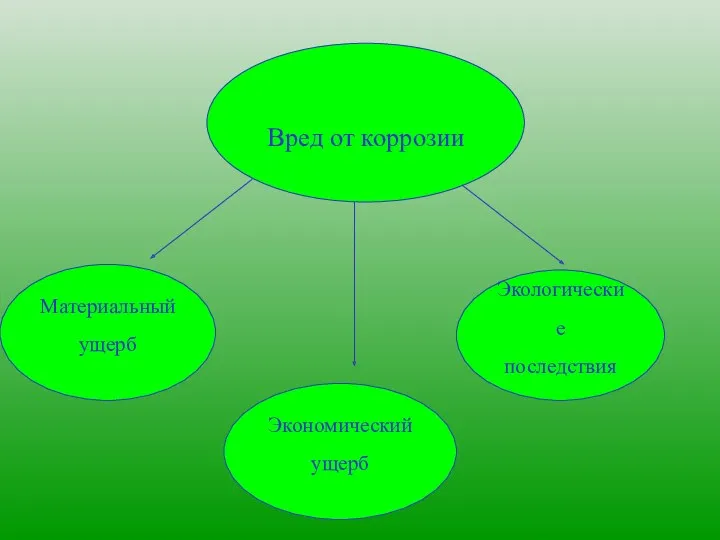
- 4. Вред от коррозии Материальный ущерб Экономический ущерб Экологические последствия
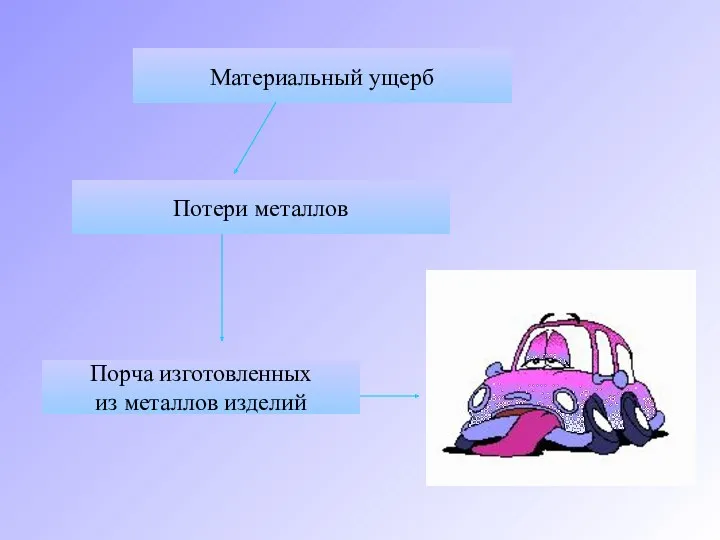
- 5. Материальный ущерб Потери металлов Порча изготовленных из металлов изделий
- 6. Затраты на ремонт, замену деталей судов, автомобилей, аппаратуры, приборов, коммуникаций во много раз превышают стоимость металла.
- 7. Утечка нефти, газов из разрушенных коррозией трубопроводов Загрязнение окружающей среды Отрицательное воздействие на здоровье людей Экологические
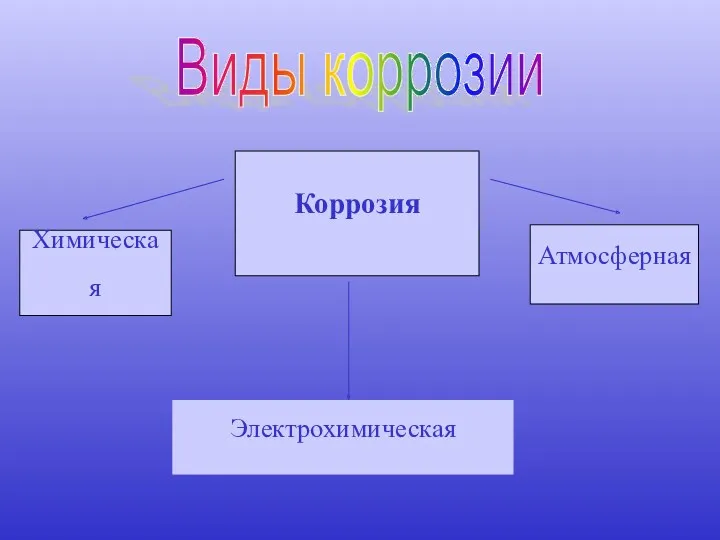
- 8. Виды коррозии Химическая Атмосферная Электрохимическая Коррозия
- 9. Химическая: под действием газов в отсутствии влаги, при действии высокой температуры.
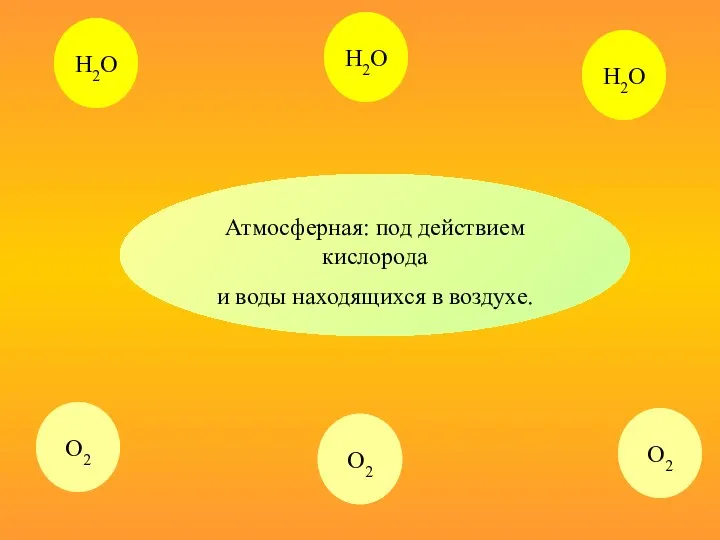
- 10. Атмосферная: под действием кислорода и воды находящихся в воздухе. Н2О Н2О О2 О2 Н2О О2
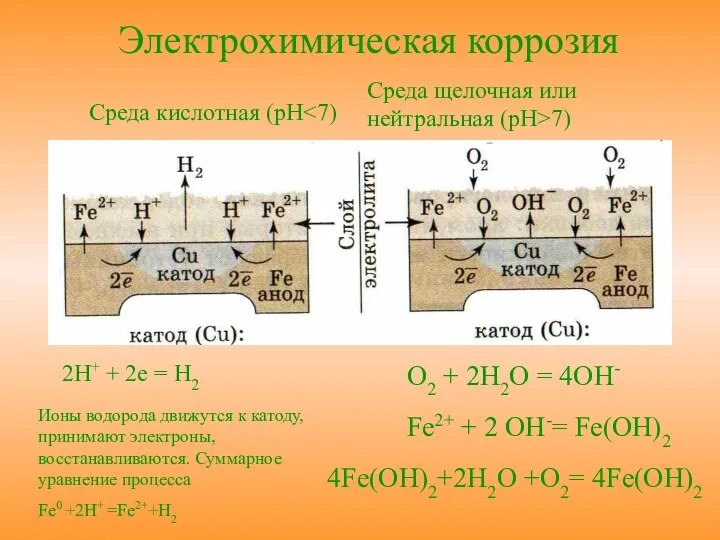
- 11. Среда щелочная или нейтральная (pH>7) Среда кислотная (pH 2H+ + 2e = H2 Ионы водорода движутся
- 12. Методы защиты металлов от коррозии
- 13. Покрытия Изоляция металла от внешней среды Неметаллические: Металлические Химические: Краски Эмали Смолы Масла Полимеры Лаки Цинкование
- 14. Применение легированных сплавов Пассивация металла Введение в состав стали легирующих элементов: Сr, Ni, AI, Mn, Mo,
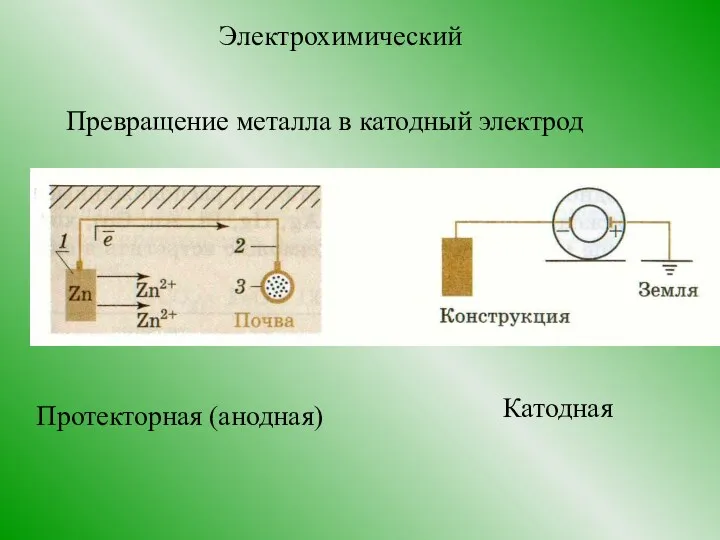
- 15. Электрохимический Превращение металла в катодный электрод Протекторная (анодная) Катодная
- 17. Скачать презентацию








 Авиационные катастрофы
Авиационные катастрофы 6-б класс
6-б класс School. Урок-повторение лексики
School. Урок-повторение лексики ПРЕЗЕНТАЦИЯ РОДОВОЕ ПОМЕСТЬЕ
ПРЕЗЕНТАЦИЯ РОДОВОЕ ПОМЕСТЬЕ Шиповое соединение. Заточка деревообрабатывающего инструмента. 7 класс
Шиповое соединение. Заточка деревообрабатывающего инструмента. 7 класс Хәрәкәттә - бәрәкәт. Диск
Хәрәкәттә - бәрәкәт. Диск Проект на тему Человек, которым я горжусь. Владимир Иванович Даль 1801-1872
Проект на тему Человек, которым я горжусь. Владимир Иванович Даль 1801-1872 Перевозка воинских эшелонов железнодорожным транспортом
Перевозка воинских эшелонов железнодорожным транспортом Заяц
Заяц Вода вещество привычное и необычное
Вода вещество привычное и необычное Презентация к уроку по теме Алкены базовый уровень Диск
Презентация к уроку по теме Алкены базовый уровень Диск Пищевые ресурсы человечества. Проблемы питания и производства сельскохозяйственной продукции
Пищевые ресурсы человечества. Проблемы питания и производства сельскохозяйственной продукции Презентация к занятию Путешествие в страну Фантазии
Презентация к занятию Путешествие в страну Фантазии Презентация сложение целых чисел
Презентация сложение целых чисел Федор Михайлович Достоевский 1821-1881
Федор Михайлович Достоевский 1821-1881 Тебе!)
Тебе!) Физминутки
Физминутки Основные права и свободы человека и гражданина
Основные права и свободы человека и гражданина Развлечение группы Кроха 8 Марта. В гости к нам пришла матрешка
Развлечение группы Кроха 8 Марта. В гости к нам пришла матрешка Направления и каналы передачи технологий. (Тема 4)
Направления и каналы передачи технологий. (Тема 4) Вечеря Господня
Вечеря Господня Pārtikas produktu kvalitāte jana belāne
Pārtikas produktu kvalitāte jana belāne Дизайн проект квартиры. Москва, Тишинский переулок 38
Дизайн проект квартиры. Москва, Тишинский переулок 38 Уход за больными с переломом шейки бедра
Уход за больными с переломом шейки бедра Пусковой комплекс 9. Перевод ПРК на газ
Пусковой комплекс 9. Перевод ПРК на газ Влияние условий внешней среды на микроорганизмы
Влияние условий внешней среды на микроорганизмы Родная природа в лирике поэтов ХХ века
Родная природа в лирике поэтов ХХ века Методы генетики человека
Методы генетики человека