Слайд 2
Выполните задания:
Из предложенного перечня веществ подчеркните отдельно формулы оксидов и оснований, в
соответствии с известной вам классификацией, и дайте им названия:
K2O , Fe(OH)2, CO2 , H2SO4 , NaOH, Al2O3, Cu(OH)2, HCl, N2O5.

Слайд 3
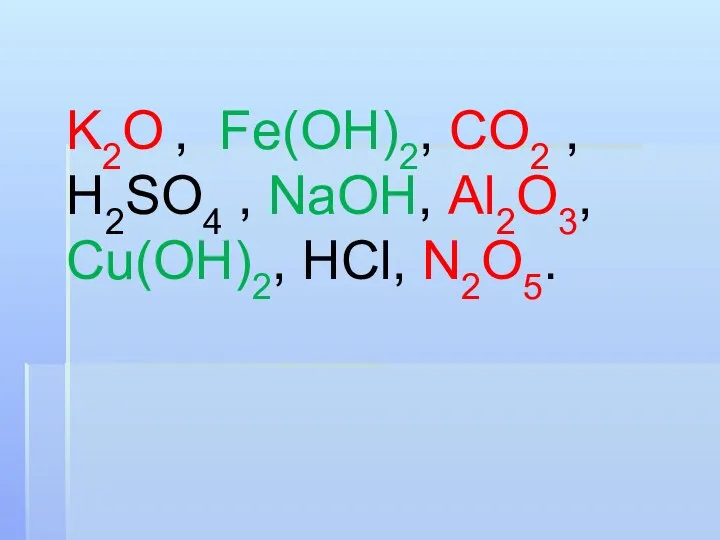
K2O , Fe(OH)2, CO2 , H2SO4 , NaOH, Al2O3, Cu(OH)2, HCl, N2O5.
Слайд 4

Слайд 5
ЗАДАЧИ УРОКА:
сформировать понятие о кислотах;
уяснить их состав, номенклатуру,
рассмотреть их классификацию по
разным признакам;
- узнать, как действуют индикаторы на кислоты;
- более подробно познакомиться с отдельными представителями кислот,
- узнать роль кислот в народном хозяйстве и в быту

Слайд 6
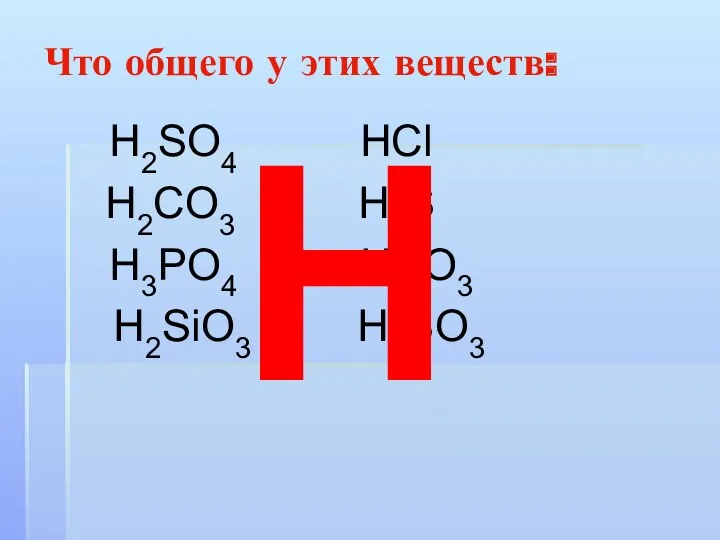
Что общего у этих веществ:
Н2SO4 НСl
Н2CO3 Н2S
Н3РO4 НNO3
Слайд 7
Что такое кислоты?
Сложные вещества, молекулы которых состоят из атомов водорода и кислотного
остатка

Слайд 8
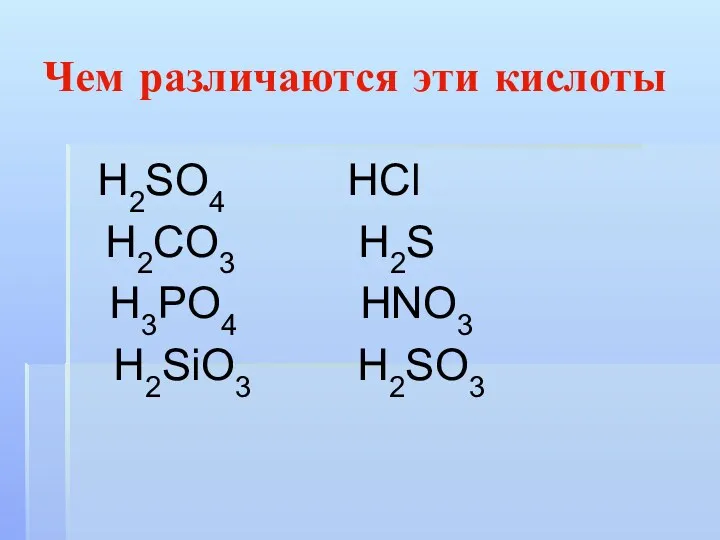
Чем различаются эти кислоты
Н2SO4 НСl
Н2CO3 Н2S
Н3РO4 НNO3
Н2SiO3
Н2SO3
Слайд 9
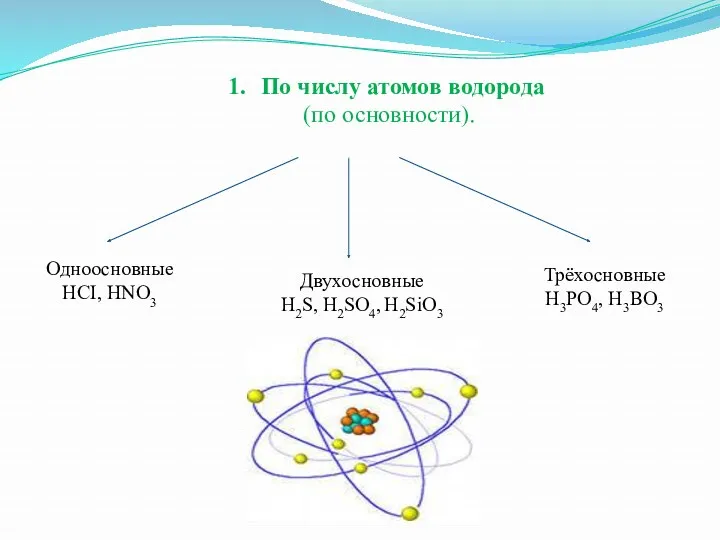
По числу атомов водорода
(по основности).
Одноосновные
HCI, HNO3
Трёхосновные
H3PO4, H3BO3
Двухосновные
H2S, H2SO4, H2SiO3
Слайд 10
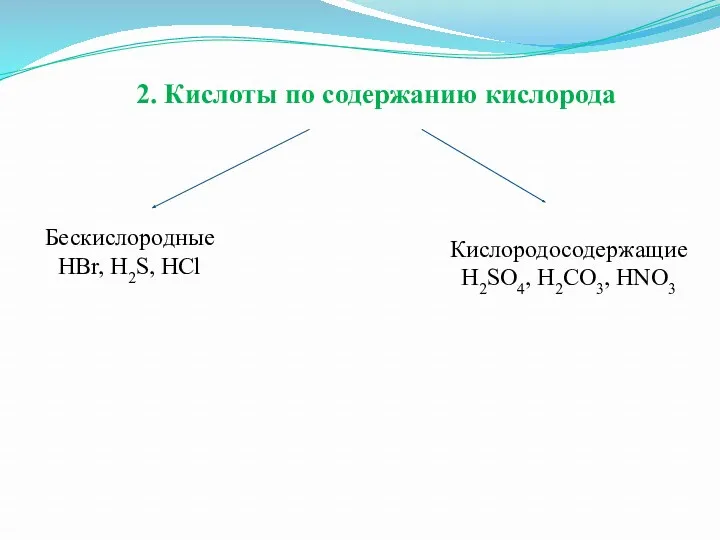
2. Кислоты по содержанию кислорода
Бескислородные
HBr, H2S, HCl
Кислородосодержащие
H2SO4, H2CO3, HNO3
Слайд 11
3. Растворимость кислот.
Обратите внимание на таблицу растворимости кислот (в учебнике). Какой вывод вы
можете сделать? (Единственная нерастворимая кислота – кремниевая H2SO3)

Слайд 12
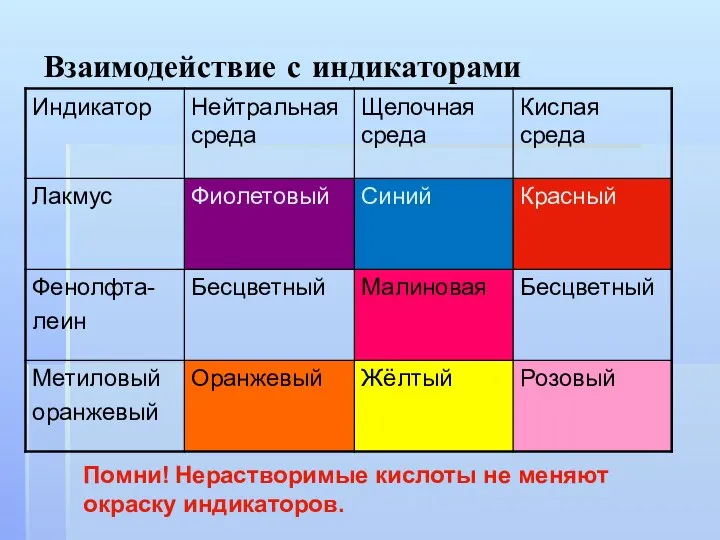
Взаимодействие с индикаторами
Помни! Нерастворимые кислоты не меняют окраску индикаторов.
Слайд 13
Задание 1
Используя таблицу растворимости кислот, оснований и солей в воде, составьте формулы
разных кислот, дайте им названия, определите тип химической связи.
Н, Н2, Н3 , S, NО2, РО4, СI, SО3

Слайд 14
Задание 2
«Третий лишний»:
В каждой строчке найти лишнюю формулу:
Н2S, Н2 SО4
, Н2SО3,
Н2СО3, Н3 РО4, Н2 SО4

Слайд 15
Домашняя работа
1. П. 20, упр. №3, стр. 107
2. Задача №4, стр.107
3. Задание по выбору:
- Подготовить сообщение :
1. «Кислотные дожди»
2. «Кислоты в природе и их применение в быту»
- Составить кроссворд по теме «Кислоты»















 Основы рабочего процесса ГТД
Основы рабочего процесса ГТД Различие программ Звуки и буквы
Различие программ Звуки и буквы Презентация Интеллект-карта как метод формирования учебно-познавательной компетенции обучающихся.
Презентация Интеллект-карта как метод формирования учебно-познавательной компетенции обучающихся. Интеллектуальная игра
Интеллектуальная игра Накопления и сбережения
Накопления и сбережения презентация программы Начальная школа XXI века
презентация программы Начальная школа XXI века Труженики тыла в Великой Отечественной войне 1941-1945 гг. (п.Сборный Сызранского района Самарской области) презентация ч.2
Труженики тыла в Великой Отечественной войне 1941-1945 гг. (п.Сборный Сызранского района Самарской области) презентация ч.2 Услуги сетей телекоммуникаций
Услуги сетей телекоммуникаций Пылающий адрес войны - Киров
Пылающий адрес войны - Киров Основные типы задач на проценты
Основные типы задач на проценты Джовані Боккаччо
Джовані Боккаччо Prezentatsia_Vitaliy
Prezentatsia_Vitaliy Гендер, сексуальность и пол
Гендер, сексуальность и пол Сочинение-описание. Васнецов. Богатыри
Сочинение-описание. Васнецов. Богатыри Необычные тапочки. Тапочки - из бумаги
Необычные тапочки. Тапочки - из бумаги IP-маршрутизация
IP-маршрутизация Программно-нормативные основы физического воспитания школьников
Программно-нормативные основы физического воспитания школьников Резервуарлар. Мұнай резервуарлары деп
Резервуарлар. Мұнай резервуарлары деп Презентация для урока повторения по тема Приёмы быстрого деления. 5 класс
Презентация для урока повторения по тема Приёмы быстрого деления. 5 класс ЭОСВ
ЭОСВ Особенности перемещения через таможенную границу и совершения таможенных операций в отношении водных биоресурсов
Особенности перемещения через таможенную границу и совершения таможенных операций в отношении водных биоресурсов Технологический контроль процесса бурения. Подъемная система. Породоразрушающая система. Растворная система
Технологический контроль процесса бурения. Подъемная система. Породоразрушающая система. Растворная система Создание учителем условий для приобретения обучающимися позитивного социального опыта
Создание учителем условий для приобретения обучающимися позитивного социального опыта Презентация для классного часа Наследие п.Магдагачи - памятники М.Курбатову
Презентация для классного часа Наследие п.Магдагачи - памятники М.Курбатову Мое творчество
Мое творчество ch
ch Крайние точки России
Крайние точки России конкурс по экологии
конкурс по экологии