Слайд 2
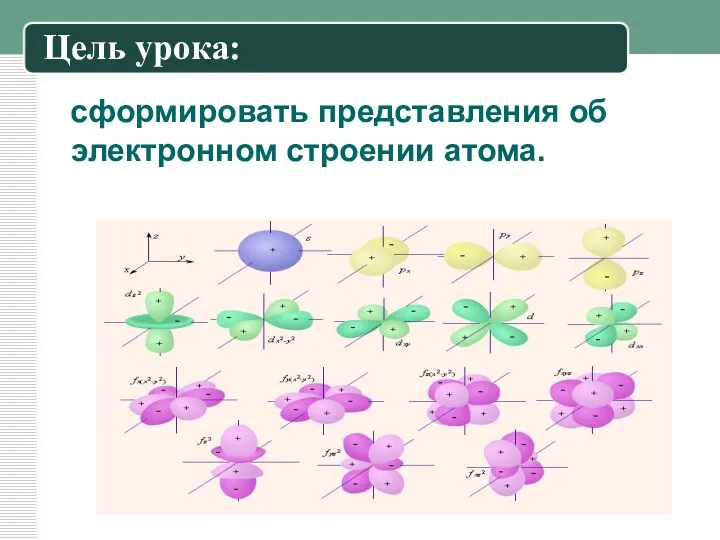
Цель урока:
сформировать представления об электронном строении атома.
Слайд 3

Задачи:
познакомиться со строением электронной оболочки атома (уровни, подуровни, орбитали);
научиться определять количество
и виды энергетических уровней в атоме;
научиться рассчитывать число электронов на уровнях, подуровнях и орбиталях;
познакомиться с алгоритмом
составления схемы строения атома.
Слайд 4

Электронная оболочка
Состоит из энергетических уровней или электронных слоев.
Число энергетических уровней в
атоме равно номеру периода.
Энергетические уровни обозначают:
+ х ) ) ) и т. д.
↑
заряд ядра
Слайд 5

Энергетические уровни бывают: внутренние и внешние
+ х ) ) ) →
внешний уровень
↑
внутренние уровни
Пример:
Р – фосфор, 3 период → 3 энергетических уровня
Р: + 15 ) ) )
Слайд 6

Количество электронов на уровнях
Nе (внутр) = 2n2,
где n -
номер уровня.
Nе (внешн) = № (группы)
- для элементов главных подгрупп.
Пример:
1 2 3
Р: + 15 ) ) )
2 8 5
Слайд 7

Строение энергетических уровней
Каждый энергетический уровень состоит из подуровней.
Число подуровней в
уровне равно номеру уровня.
1 уровень – 1 подуровень → s
2 уровень – 2 подуровня → s, p
3 уровень – 3 подуровня → s, p, d.
Слайд 8
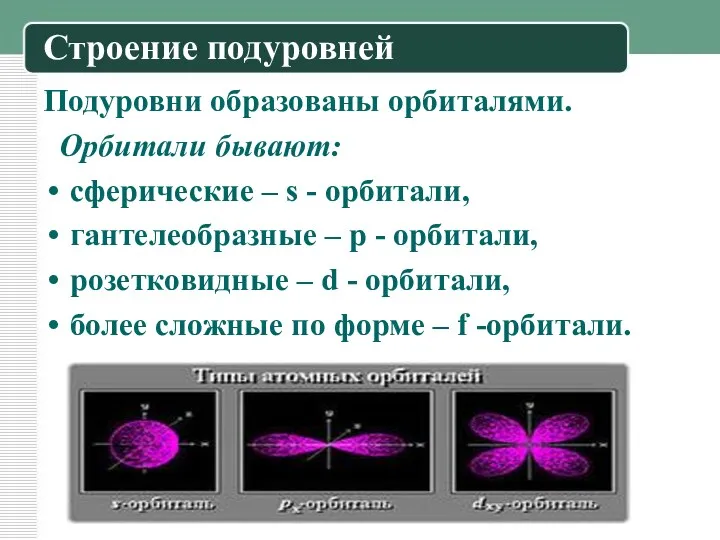
Строение подуровней
Подуровни образованы орбиталями.
Орбитали бывают:
сферические – s - орбитали,
гантелеобразные –
р - орбитали,
розетковидные – d - орбитали,
более сложные по форме – f -орбитали.
Слайд 9

Количество орбиталей на подуровнях
s -подуровень - 1 орбиталь
p - подуровень –
3 орбитали
d - подуровень - 5 орбиталей
f - подуровень - 7 орбиталей
На каждой орбитали может находиться только два электрона.
Слайд 10
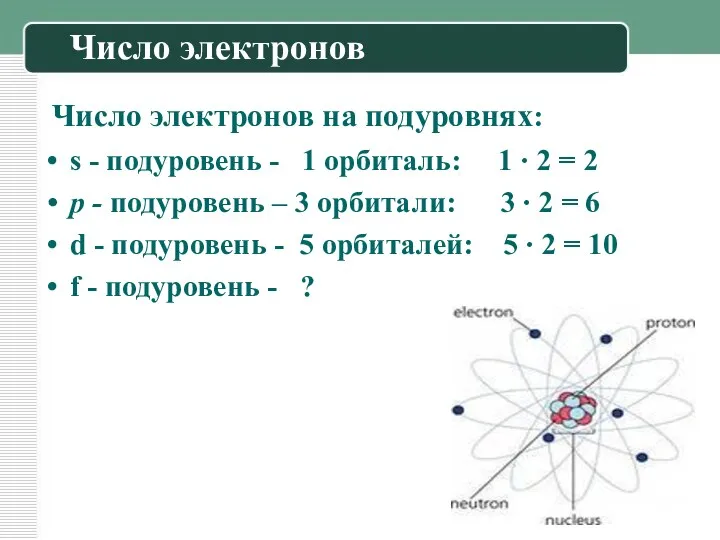
Число электронов
Число электронов на подуровнях:
s - подуровень - 1
орбиталь: 1 ∙ 2 = 2
р - подуровень – 3 орбитали: 3 ∙ 2 = 6
d - подуровень - 5 орбиталей: 5 ∙ 2 = 10
f - подуровень - ?
Слайд 11

Схема строения атома (алгоритм)
Запишем знак химического элемента.
По порядковому номеру определим
заряд ядра атома, укажем его.
По номеру периода определим число энергетических уровней, отобразим их.
Определим количество электронов на каждом уровне. Укажем их.
Слайд 12

Например: селен.
34 Se 4 период, 6 группа, А
+ 34 ) ) ) )
2 8 18 6
Слайд 13

Электронная формула атома
Показывает, на каких уровнях и подуровнях располагаются электроны,
сколько их на каждом подуровне.
1s22s22p63s23p63d104s24p4












 Урок Мужества Женя Табаков
Урок Мужества Женя Табаков Найди своего героя
Найди своего героя Целеполагание на уроке биологии
Целеполагание на уроке биологии Сказки про усатых-полосатых
Сказки про усатых-полосатых Исследование темы История моей семьи
Исследование темы История моей семьи ЛЕГО - конструирование – модная игра или серьёзное занятие?
ЛЕГО - конструирование – модная игра или серьёзное занятие? Стандарты и нормы. Юридические (правовые) аспекты УП
Стандарты и нормы. Юридические (правовые) аспекты УП Презентация День Знаний
Презентация День Знаний Реформы 1860–1870 годов в России, их последствия и значение
Реформы 1860–1870 годов в России, их последствия и значение А. Барто - поэзия доброты
А. Барто - поэзия доброты Альтернативные источники энергии. Ветроэнергетика
Альтернативные источники энергии. Ветроэнергетика Кого направить к кардиологу
Кого направить к кардиологу ФГОС НОО второго поколения
ФГОС НОО второго поколения Первый в Ижевске бассейн премиум класса для детей от рождения до 7 лет
Первый в Ижевске бассейн премиум класса для детей от рождения до 7 лет День открытых дверей в ТОГБПОУ Тамбовский областной медицинский колледж
День открытых дверей в ТОГБПОУ Тамбовский областной медицинский колледж Сервировка стола для кофе
Сервировка стола для кофе Изготовление Деда Мороза из бумаги
Изготовление Деда Мороза из бумаги Животный мир Австралии
Животный мир Австралии Территориальный маркетинг в системе регионального управления
Территориальный маркетинг в системе регионального управления Основы гражданского права
Основы гражданского права Международные экономические и финансовые организации
Международные экономические и финансовые организации Презентация Что такое наблюдение? Виды педагогических наблюдений.Алгоритм действия педагога при наблюдении..
Презентация Что такое наблюдение? Виды педагогических наблюдений.Алгоритм действия педагога при наблюдении.. Система контроля и управления доступом Сфинкс Школа
Система контроля и управления доступом Сфинкс Школа Шумы в усилительных каскадах
Шумы в усилительных каскадах Солнечная система. Интерактивный тест Диск
Солнечная система. Интерактивный тест Диск Мочевыделительная система
Мочевыделительная система Классный час
Классный час Для тех, кто влюблен в аккордеон.
Для тех, кто влюблен в аккордеон.