Содержание
- 2. Цели урока Обобщить и закрепить знания о классификации неорганических веществ; научить на основании состава молекулы вещества
- 3. Основные понятия Вещества простые- металлы, неметаллы; сложные- оксиды, кислоты, соли; гидроксиды- основания, гидроксиды – кислоты, амфотерность;
- 4. Оборудование Коллекция «Металлы», «Неметаллы» - сера, графит; модели типов кристаллических решеток, таблица; Br2,I2, фосфор красный; оксиды:
- 5. План урока Классификация веществ. Определение простых и сложных веществ. Классификация простых веществ: металлы и неметаллы. Строение
- 6. Классификация веществ
- 7. Химические элементы
- 8. Химические соединения
- 9. Неорганические вещества
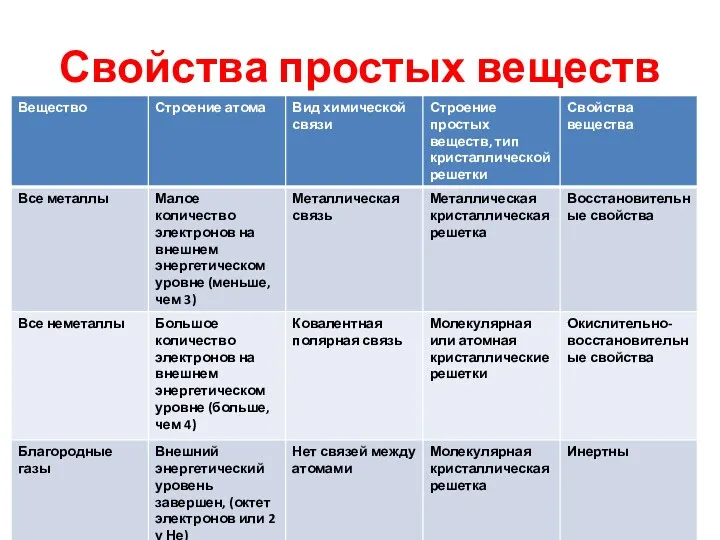
- 10. Классификация простых веществ Все простые вещества на основании строения атомов, вида химической связи, типа кристаллических решеток,
- 11. Свойства простых веществ
- 13. План характеристики сложного вещества Определение класса Классификации; название. Признаки (химическая связь) строения вещества. Физические свойства. Значение
- 14. Оксиды - ЭмOn Это сложные вещества, состоящие из двух химических элементов, один из которых – кислород
- 16. По свойствам
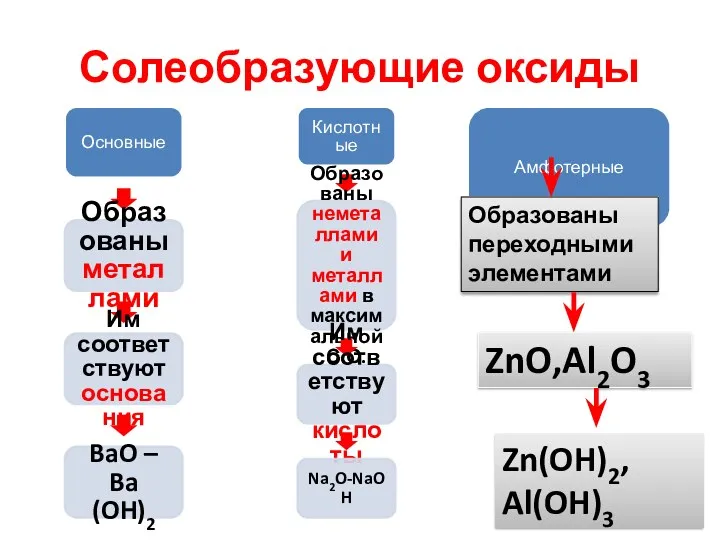
- 17. Солеобразующие оксиды Образованы переходными элементами ZnO,Al2O3 Zn(OH)2, Al(OH)3
- 18. Несколько степеней окисления В названии оксида обязательно указывается С.О., если образующий элемент имеет несколько С.О. +4-2
- 19. Несолеобразующие оксиды (безразличные) СО – оксид углерода (II) NO - оксид азота (II) N2O - оксид
- 20. Химическая связь и кристаллические решетки у оксидов Оксиды, образованные: металлами, имеют ионную связь, переходными металлами- ковалентную
- 21. Демонстрация коллекций минералов и горных пород Кварц (SiO2) Корунд (Al2O3) Асбест (СаО . 3МgО . 4SiO2)
- 22. В состав воздуха входят (оксиды): Оксид углерода (IV) - СО2 Вода - H2O Вредные примеси, СО
- 23. Применение оксидов H2O – важнейший минерал Земли участвует в круговороте веществ. SiO2 - оксид кремния, входит
- 24. Основания- М+у(ОН)у где у – число гидроксогрупп, равное степени окисления металла М+у Основания- это сложные вещества,
- 25. Классификация оснований по растворимости в воде
- 26. Химическая связь и кристаллические решетки у оснований Основания имеют ионную связь между металлом и гидроксогруппой, в
- 27. Амфотерные основания- это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. нерастворимы в воде,
- 28. Применение оснований NaOH- гидроксид натрия, «едкий натр»; очистка нефтепродуктов, отбеливание бумаги, производство мыла, осушка газов в
- 29. Применение оснований Al(OH)3- гидроксид алюминия, медицина – алмагель, препарат, обладающий обволакивающим адсорбирующим действием. AlCl3+3 NH4OH= Al(OH)3↓+3NH4Cl
- 30. Кислоты- НхАс где Ас – кислотный остаток (от англ. - acid-кислота), х- число атомов водорода, равное
- 31. По наличию кислорода в молекуле
- 32. По количеству атомов водорода в молекуле
- 33. Химическая связь и кристаллические решетки у кислот Химическая связь между атомами в кислотах ковалентная полярная. Строение
- 34. Использование кислот H2SO4 – серная кислота; производство минеральных удобрений, солей бескислородных кислот; очистка нефтепродуктов, поверхностей металлов;
- 35. Использование кислот Н3РО4 – фосфорная кислота; производство удобрений; HCl – соляная кислота; травление металлов, производство солей,
- 36. Соли это сложные вещества, состоящие из катионов металла ( иона аммония) и анионов кислотных остатков.
- 38. Средние соли это продукты полного замещения атомов водорода в молекуле кислоты атомами металла (иона аммония) или
- 39. Кислые соли это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла (иона аммония).
- 40. Основные соли это продукты неполного замещения гидроксогрупп в многокислотных основаниях кислотными остатками. Fe(OH)3 → (FeOH)Cl2 Fe(OH)2Cl
- 41. Двойные и комплексные соли отличаются друг от друга характером диссоциации в водных растворах. Двойные соли диссоциируют
- 42. Координационная теория А.Вернера Комплексные (координационные) соединения построены так: в центре находится атом или ион-комплексообразователь (им может
- 43. Координационная теория А.Вернера Общее число лигандов, непосредственно связанных с центральным атомом, называется координационным числом. Ион- комплексообразователь
- 44. Координационная теория А.Вернера Наиболее характерны: Кч=2 (Cu+, Ag+, Au+) Кч=4 (Cu2+, Au3+,Zn2+,Pb2+,Pt2+,Al3+) Кч=6 (Fe2+, Fe3+, Ni2+,
- 45. Строение тетрагидроксоцинката натрия внутренняя среда внешняя сфера Na2 [Zn(OH)4] комплексообразователь лиганды координационное число=4 Уравнение диссоциации: Na2
- 46. Классификация комплексных солей
- 47. Катионные комплексы [Cu(NH3)4]2+SO42- cульфат-тетраммин меди (II) название составляется, начиная с аниона молекулы; ион-комплексообразователя назван по-русски в
- 48. Анионные комплексы Na2+[Zn(OH)4]2- тетрагидроксоцинкат натрия ион- комплексообразователь называем по латыни с суффиксом «ат»
- 49. Нейтральные комплексы Ион-комплексообразователь называем по-русски в именительном падеже: [Fe(CO)5] пента-карбонил-железо
- 50. Значение комплексных соединений в природе Огромное: Хлорофилл- комплексное соединение, ионом-комплексообразователем является магний; хлорофилл отвечает за фотосинтез.
- 51. Химическая связь и кристаллические решетки у солей В солях присутствует ионная связь, ковалентная полярная связь, а
- 52. Значение солей В повседневной жизни соли имеют огромное значение: в быту NaHCO3 - гидрокарбонат натрия, пищевая
- 53. Значение солей минеральные удобрения: азотные NH4NO3- нитрат аммония, калийные KCl – хлорид калия, фосфорные (NH4)2HPO4- гидрофосфат
- 54. Источники Химия. 11 класс. Профильный уровень:учеб.для общеобразоват.учреждений/О.С.Габриелян, Г.Г.Лысова.-М.:Дрофа, 2008. Троегубова Н.П. Поурочные разработки по химии:11 класс.
- 56. Скачать презентацию









































![Строение тетрагидроксоцинката натрия внутренняя среда внешняя сфера Na2 [Zn(OH)4] комплексообразователь](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/449819/slide-44.jpg)

![Катионные комплексы [Cu(NH3)4]2+SO42- cульфат-тетраммин меди (II) название составляется, начиная с](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/449819/slide-46.jpg)
![Анионные комплексы Na2+[Zn(OH)4]2- тетрагидроксоцинкат натрия ион- комплексообразователь называем по латыни с суффиксом «ат»](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/449819/slide-47.jpg)
![Нейтральные комплексы Ион-комплексообразователь называем по-русски в именительном падеже: [Fe(CO)5] пента-карбонил-железо](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/449819/slide-48.jpg)





 Театры в Чебоксарах
Театры в Чебоксарах Узнай свой город. Часть 1
Узнай свой город. Часть 1 Подготовка обучающихся 5-6 классов в освоению курсов Алгебра и Геометрия
Подготовка обучающихся 5-6 классов в освоению курсов Алгебра и Геометрия Методическая разработка урока по химии Металлы
Методическая разработка урока по химии Металлы Проектная деятельность учащихся на уроках музыки
Проектная деятельность учащихся на уроках музыки Автоматизация экспериментальных исследований
Автоматизация экспериментальных исследований Мыло, и иные моющие средства
Мыло, и иные моющие средства Основні типи невпорядкованості напівпровідникових кристалів. (Лекція 1)
Основні типи невпорядкованості напівпровідникових кристалів. (Лекція 1) Внеурочная работа в начальной школе
Внеурочная работа в начальной школе Группа 310. Выпускной
Группа 310. Выпускной 125929
125929 Суть учения. Исцеление наше право
Суть учения. Исцеление наше право Потенциал образовательных событий в подготовке студентов к педагогической деятельности
Потенциал образовательных событий в подготовке студентов к педагогической деятельности T7 Electrical Schematic
T7 Electrical Schematic Центр Прикладной Урбанистики
Центр Прикладной Урбанистики Презентация Мир воды. Диск
Презентация Мир воды. Диск Изучение электродвигателя. Занятие 3
Изучение электродвигателя. Занятие 3 Основы информационных технологий
Основы информационных технологий Северная Америка. Канада
Северная Америка. Канада Атом энергетикасы өндірісі мен радиологиялық нысандардағы апаттардың себебінен жіктелуі және олардың салдарының масштабы
Атом энергетикасы өндірісі мен радиологиялық нысандардағы апаттардың себебінен жіктелуі және олардың салдарының масштабы Ишемический инсульт
Ишемический инсульт Введение в неврологию. Классификация нервной системы, ее значение в деятельности организма. Нейрон, нейроглия
Введение в неврологию. Классификация нервной системы, ее значение в деятельности организма. Нейрон, нейроглия Лекарства на грядке
Лекарства на грядке Современное изобразительное искусство
Современное изобразительное искусство Литературный поиск. Базы данных
Литературный поиск. Базы данных Важность использования напорно -всасывающего рукава
Важность использования напорно -всасывающего рукава Рассеянный склероз
Рассеянный склероз Классицизм в живописи. Николя Пуссен
Классицизм в живописи. Николя Пуссен