Содержание
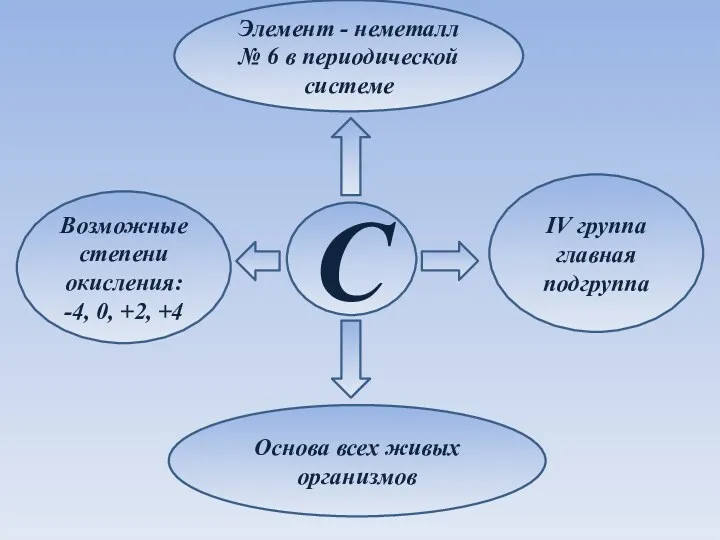
- 2. Элемент - неметалл № 6 в периодической системе C IV группа главная подгруппа Возможные степени окисления:
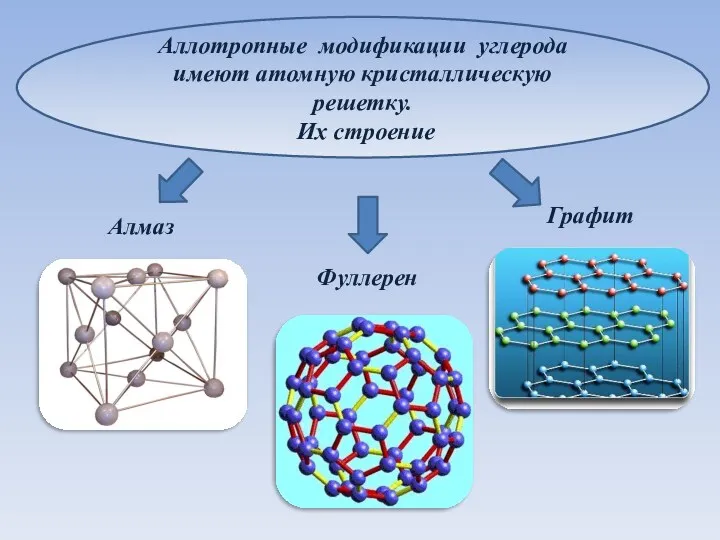
- 3. Аллотропные модификации углерода имеют атомную кристаллическую решетку. Их строение Алмаз Графит Фуллерен
- 4. Алмаз Применяется в: Обрабатывающей промышленности Электротехнике Горной промышленности Ювелирном производстве …это самое твердое вещество на Земле,
- 5. Графит …это мягкое серо-черное вещество, тугоплавкое , являющееся полупроводником со слоистой структурой. Применяется в: Графитовых стержнях-электродах
- 6. Фуллерен Фуллерены планируют использовать: 1. Для создания фотоприемников 2. Для создания сверхпроводящих материалов 3. В качестве
- 7. Нахождение в природе Мел, известняк, мрамор CaCO3 Магнезит MgCO3 Сидерит FeCO3 В самородном виде: алмаз и
- 8. В составе растений и животных (~18 %). В организме человека достигает около 21 % (15 кг
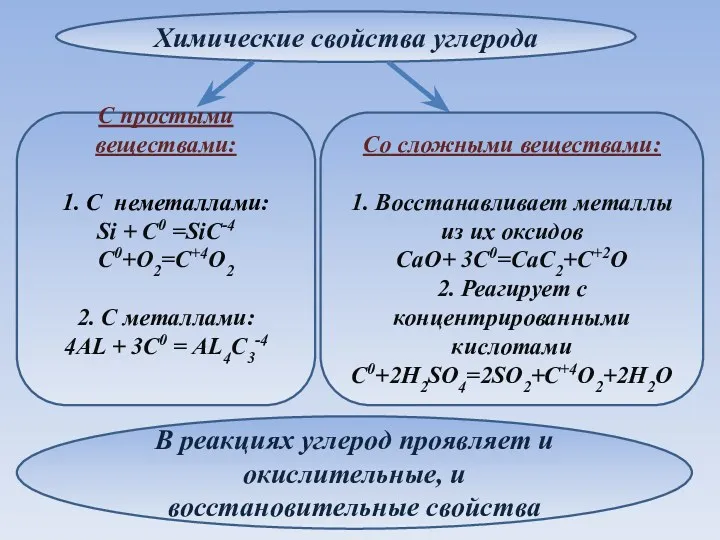
- 9. Химические свойства углерода Со сложными веществами: 1. Восстанавливает металлы из их оксидов CaO+ 3C0=CaC2+C+2O 2. Реагирует
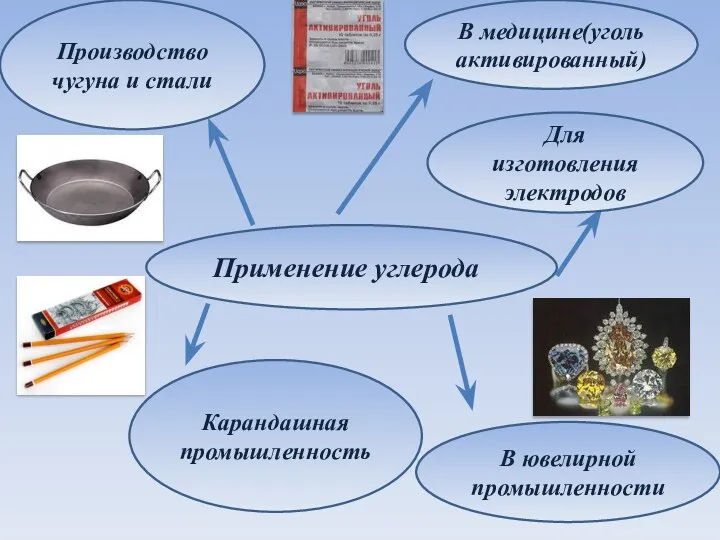
- 10. Применение углерода Производство чугуна и стали В медицине(уголь активированный) Карандашная промышленность Для изготовления электродов В ювелирной
- 12. Скачать презентацию





 Презентация Сказочное оригами
Презентация Сказочное оригами Османская империя накануне революции. Середина XIX в
Османская империя накануне революции. Середина XIX в Презентация кружка по ПДД
Презентация кружка по ПДД Систематика растений
Систематика растений Дизайн научного исследования при проведении медико-биологических исследований
Дизайн научного исследования при проведении медико-биологических исследований Aviation English
Aviation English Логопедический массаж. Диск
Логопедический массаж. Диск Допустимые уловы (ОДУ) водных биологических ресурсов на 2020 год в Удмуртском секторе Воткинского водохранилища
Допустимые уловы (ОДУ) водных биологических ресурсов на 2020 год в Удмуртском секторе Воткинского водохранилища ОМОН (Отряд мобильный особого назначения, ранее — Отряд милиции особого назначения)
ОМОН (Отряд мобильный особого назначения, ранее — Отряд милиции особого назначения) Электротехника в школе
Электротехника в школе Случаи вычитания 17-, 18-
Случаи вычитания 17-, 18- Анализ содержания программ лагерей с дневным пребыванием детей, актуальные вопросы подготовки программ на летний период
Анализ содержания программ лагерей с дневным пребыванием детей, актуальные вопросы подготовки программ на летний период Определение интерпретационных параметров ГИС по керну
Определение интерпретационных параметров ГИС по керну Наши пальчики играют
Наши пальчики играют The main directions of scientific activity of the Department of Forest Protection and Wood Science
The main directions of scientific activity of the Department of Forest Protection and Wood Science игра-презентация Убери в комнате.
игра-презентация Убери в комнате. Правовой статус редакции
Правовой статус редакции Обзор возможностей календаря Google
Обзор возможностей календаря Google Образцы моделей выполнения упражнений
Образцы моделей выполнения упражнений Өндірістік және әлеуметтік технология
Өндірістік және әлеуметтік технология Вадбольская Георгиевская (Егорьева) мужская пустынь
Вадбольская Георгиевская (Егорьева) мужская пустынь Резюме
Резюме Презентация Летопись нашего класса
Презентация Летопись нашего класса Новогодняя Снежинка-пушинка. Мастер-класс
Новогодняя Снежинка-пушинка. Мастер-класс Презентация: из истории Памятника Архитектуры и культуры Краснодарского края Свято-Троицкого храма ст. Платнировской. 1906 - 2011
Презентация: из истории Памятника Архитектуры и культуры Краснодарского края Свято-Троицкого храма ст. Платнировской. 1906 - 2011 Хозяйство Европейского Юга
Хозяйство Европейского Юга Технические каналы утечки информации на объектах информатизации Вооруженных Сил
Технические каналы утечки информации на объектах информатизации Вооруженных Сил Урок технологии в 3 классе Золотая рыбка
Урок технологии в 3 классе Золотая рыбка