Содержание
- 2. Электролиз - окислительно-восстановительные процессы, протекающие на электродах при пропускании постоянного электрического тока через раствор или расплав
- 3. Процесс перехода электрической энергии в химическую осуществляется в электролизере. При электролизе катод заряжен отрицательно, а анод
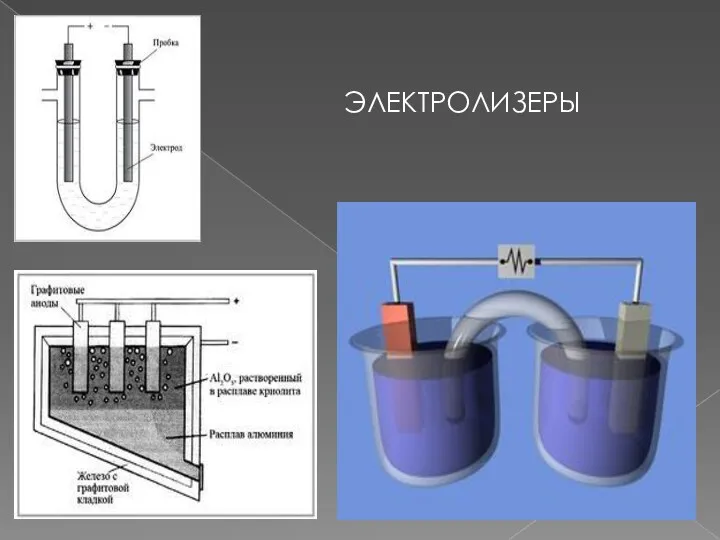
- 4. ЭЛЕКТРОЛИЗЕРЫ
- 5. Электролиз расплавов Пример электролиза расплава хлорида меди (II): CuCl2 = Cu +CL2 ↑ CuCl2 → Cu2+
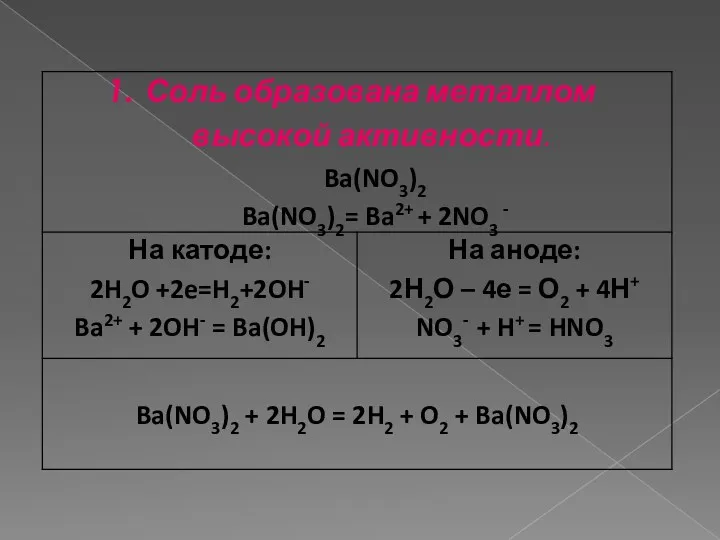
- 6. 1.Соль активного металла и бескислородной кислоты KCl ↔ K+ + Cl− K"катод"(-): K+ + 1e =
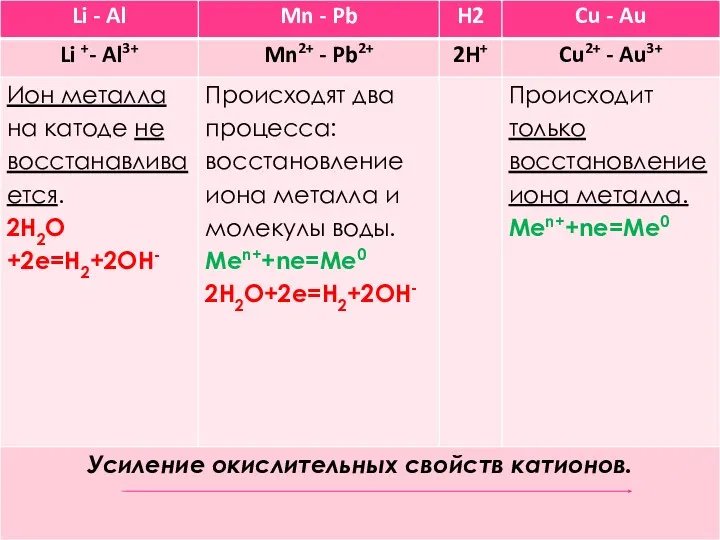
- 7. Электролиз растворов Катодные процессы определяются окислительной активностью катионов Рассмотрим таблицу:
- 9. Электролиз раствора иодида калия Анодные процессы зависят не только от характера аниона, но и от материала
- 10. В случае нерастворимого анода возможны следующие процессы:
- 14. Применение электролиза: При электролизе расплавов солей и щелочей в промышленности получают активные металлы ( щелочные, щелочноземельные,
- 15. Гальваностегия – нанесение на поверхность металла слоев других металлов с целью предохранения изделий от коррозии, придания
- 17. Скачать презентацию











 vyezdnaya_prezentatsia_AP
vyezdnaya_prezentatsia_AP Письмо
Письмо Фонетика
Фонетика Подорож містом Львів
Подорож містом Львів Презентация к внеклассному мероприятию Что значит быть хорошим сыном или дочерью.
Презентация к внеклассному мероприятию Что значит быть хорошим сыном или дочерью. Ассирийская держава
Ассирийская держава Хочу всё знать. Интеллектуальная игра для дошкольников
Хочу всё знать. Интеллектуальная игра для дошкольников Удельная теплота плавления
Удельная теплота плавления Выбор индивида. Основы теории потребления
Выбор индивида. Основы теории потребления Социокультурный потенциал развития учреждения дополнительного образования
Социокультурный потенциал развития учреждения дополнительного образования Арматурные изделия
Арматурные изделия Роль родителей в воспитании детей
Роль родителей в воспитании детей Физиология послеродового периода. Лактация. Грудное вскармливание. Контрацепция
Физиология послеродового периода. Лактация. Грудное вскармливание. Контрацепция Утилизация мусора
Утилизация мусора Педагогическая академия последипломного образования
Педагогическая академия последипломного образования Внедрение инновационных проектов – это реально (ТПП РФ)
Внедрение инновационных проектов – это реально (ТПП РФ) Презентация по теме Самый, самый ....
Презентация по теме Самый, самый .... Развитие зрительного восприятия
Развитие зрительного восприятия Клеточные и гуморальные механизмы иммунного ответа
Клеточные и гуморальные механизмы иммунного ответа Маркетинговые исследования
Маркетинговые исследования Прямая и обратная пропорциональные зависимости
Прямая и обратная пропорциональные зависимости Как происходило объединение Франции
Как происходило объединение Франции Компьютерные вирусы и антивирусные программы Типы компьютерных вирусов
Компьютерные вирусы и антивирусные программы Типы компьютерных вирусов Презентация Рождество
Презентация Рождество Особенности речевого развития у детей с перинатальным поражением ЦНС
Особенности речевого развития у детей с перинатальным поражением ЦНС Определение и понятия биографического метода
Определение и понятия биографического метода Энергетика – тарихи, әлеуметтік және экологиялык аспектілері. Казахстан республика энергетикасынын замануй тенденциялары
Энергетика – тарихи, әлеуметтік және экологиялык аспектілері. Казахстан республика энергетикасынын замануй тенденциялары Дидактическая игра Кто, где живет?
Дидактическая игра Кто, где живет?