Содержание
- 2. Цели урока: 1)Сформировать понятия о кислотах. Рассмотреть состав, названия, классификацию кислот. Познакомить учащихся с важнейшими неорганическими
- 3. Вопросы для повторения: 1)Какие классы неорганических веществ вы уже знаете? 2)Что вы знаете о кислотах? 3)Где
- 4. Нахождение кислот в природе Лимонная кислота содержится в лимонах, яблочная кислота - в яблоках, щавелевая кислота
- 5. Кислоты – это сложные вещества, содержащие атомы водорода и кислотные остатки Например: HСl, H3РO4, H2SO4
- 6. Формулы и названия основных неорганических кислот HCl хлороводородная, или соляная кислота HF фтороводородная, или плавиковая кислота
- 7. Какая из формул является общей формулой кислот? НnКm МеnКm ЭnОm Ме(ОН)n
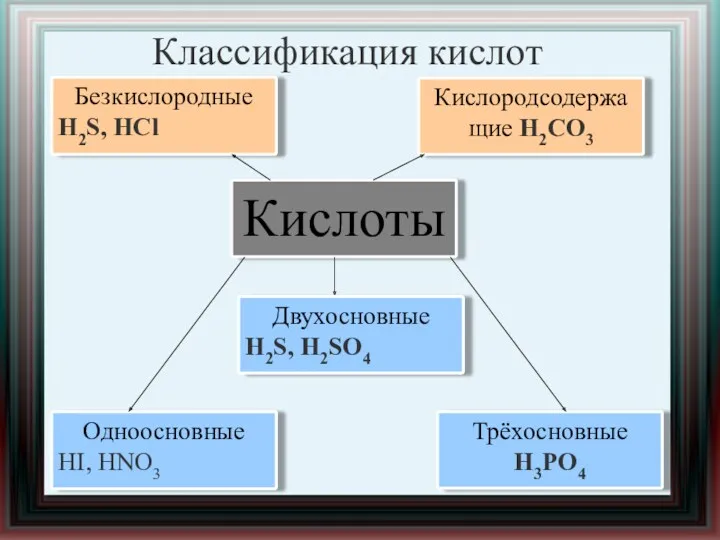
- 8. Классификация кислот Одноосновные HI, HNO3 Кислородсодержащие H2CO3 Безкислородные H2S, НСl Двухосновные H2S, H2SO4 Трёхосновные H3PO4 Кислоты
- 9. Физические свойства неорганических кислот HCl -соляная кислота H2SO4-серная кислота – жидкости HNO3 -азотная кислота H3РO4 -
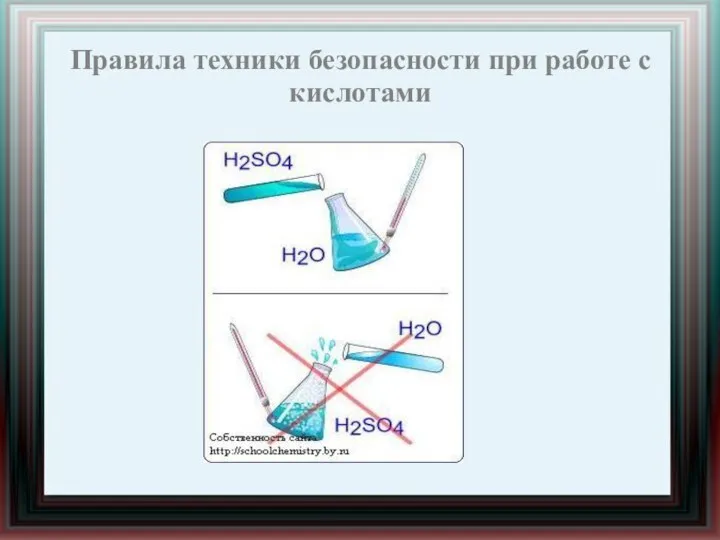
- 10. Правила техники безопасности при работе с кислотами
- 11. Правила техники безопасности при работе с кислотами С растворами кислот надо обращаться осторожно, при попадании на
- 12. Распределите формулы веществ по классам,назовите вещества кислоты основания оксиды HCl, HNO3, H2SO4, Ca(OH)2, K2O, Na2O, Al2O3,
- 13. Напишите формулы кислот, соответствущих оксидам SO3 N2O5 N2O3 CO2 SiO2 P2O5 SO2
- 14. Домашнее задание: Обязательная часть: параграф 20 страницы 102-107,упражнение 4; Необязательная часть:придумайте кроссворд по теме «Кислоты» (не
- 16. Скачать презентацию











 Буквенная запись свойств сложения и вычитания(математика 5 класс ,Виленкин)
Буквенная запись свойств сложения и вычитания(математика 5 класс ,Виленкин) Презентация к занятию по внеурочной деятельности Полдник. Пора есть булочки
Презентация к занятию по внеурочной деятельности Полдник. Пора есть булочки Автоматизация звука С в слогах
Автоматизация звука С в слогах Образование причастий
Образование причастий Железобетонный каркас промышленных одноэтажных зданий
Железобетонный каркас промышленных одноэтажных зданий Рождественский сочельник
Рождественский сочельник Коллективный проект, технология, 3 класс, Подарок ветерану
Коллективный проект, технология, 3 класс, Подарок ветерану Нация и этнос: становление и развитие теоретических положений в мировой и российской этнологии
Нация и этнос: становление и развитие теоретических положений в мировой и российской этнологии Особенности образовательного процесса в 5 классе в 2020-2021 учебном году
Особенности образовательного процесса в 5 классе в 2020-2021 учебном году Конспект занятия Хорошо и там и тут, где по имени зовут
Конспект занятия Хорошо и там и тут, где по имени зовут White and red? if you mix blue and red …
White and red? if you mix blue and red … Кружок Наши ладошки умеют всё понемножку
Кружок Наши ладошки умеют всё понемножку Викторина по русским народным сказкам
Викторина по русским народным сказкам Презентация к уроку по теме Природные ресурсы Западной Сибири (8 класс)
Презентация к уроку по теме Природные ресурсы Западной Сибири (8 класс) Дидактическая игра Четвёртый лишний. Птицы
Дидактическая игра Четвёртый лишний. Птицы Бразилия
Бразилия Презентация Программа развития УУД
Презентация Программа развития УУД Финансовый анализ предприятия и его использование в практике управления финансовыми рисками
Финансовый анализ предприятия и его использование в практике управления финансовыми рисками Конструкт урока Ъ и Ь
Конструкт урока Ъ и Ь Организация городского пассажирского транспорта (Тема 8)
Организация городского пассажирского транспорта (Тема 8) Правила варки заправочных супов
Правила варки заправочных супов Тесты по истории и культуре Санкт-Петербурга. 7 класс
Тесты по истории и культуре Санкт-Петербурга. 7 класс Древнейший период развития края. Старая Ладога
Древнейший период развития края. Старая Ладога Системы связи и оповещения в РСЧС. Групповое занятие №1.3. Телекоммуникационные сети
Системы связи и оповещения в РСЧС. Групповое занятие №1.3. Телекоммуникационные сети Устройство электровоза 2ЭВ120
Устройство электровоза 2ЭВ120 Самооценка у мальчиков и девочек старшего дошкольного возраста
Самооценка у мальчиков и девочек старшего дошкольного возраста Ознакомление с наземными радиотехническими средствами учебной базы РТОС. Отчет по лабораторной работе № 2
Ознакомление с наземными радиотехническими средствами учебной базы РТОС. Отчет по лабораторной работе № 2 Презентация к уроку 8 кл - Рельеф России
Презентация к уроку 8 кл - Рельеф России