Слайд 2

О железе
Железо – не только основа всего мира, самый главный
элемент
окружающей нас природы. Оно основа культуры и промышленности.
Оно орудие войны и мирного труда, и во всей таблице Менделеева
невозможно найти другой такой элемент , который был бы так связан с
прошлыми, настоящими и будущими судьбами человечества.
Академик Ферсман А.Е.
Слайд 3

Немного истории
В середине II тысячелетия до н.э. в Египте была основана
металлургия железа – получение его из железных руд. Это положило начало железному веку в истории человечества.
Слайд 4

Слайд 5
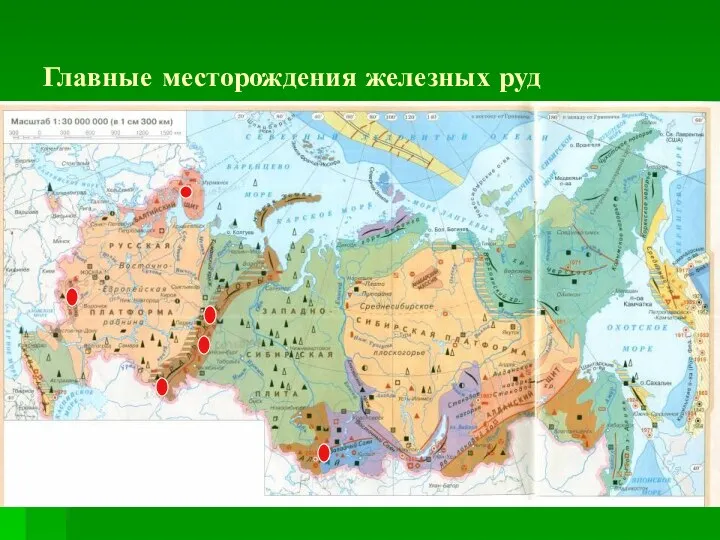
Главные месторождения железных руд
Слайд 6

Слайд 7

Железо – d-элемент.
Порядковый номер
26
Относительная атомная масса
55,847
Валентность переменная
II-III
Слайд 8

Физические свойства железа
Плотность=7,87 г/см3
Тпл = 1539ْ С
Ткип = 3200ْ С
Намагничивается
Легко обрабатывается: режется, прокатывается,
куётся
Слайд 9

Химические свойства железа
Металл средней активности
в концентрированных серной и азотной кислотах пассивируется
Слайд 10

Железо реагирует :
С простыми веществами:
Fe + S = FeS
2Fe + 3Cl2
= 2FeCl3
3Fe + 2O2 = Fe3O4 (FeO*Fe2O3)
Со сложными веществами:
3Fe + 4H2O = Fe3O4 +4H2
Fe + 2HCl = FeCl2 + H2
Fe + CuSO4 = FeSO4 + Cu
Слайд 11

Коррозия металла
Железо разрушается под действием окружающей среды – оно ржавеет
4Fe +
3O2 + 2n·H2O = 2Fe2O3·nH2 O
Состав ржавчины очень сложный
Слайд 12

Защита железа от коррозии
Лако-красочные покрытия
Эмаль – силикатное стекло с добавлением оксидов
металлов
Металлические покрытия: лужение, оцинковывание, хромирование и т.д.
Выплавление нержавеющих сталей
Ингибирование
Слайд 13
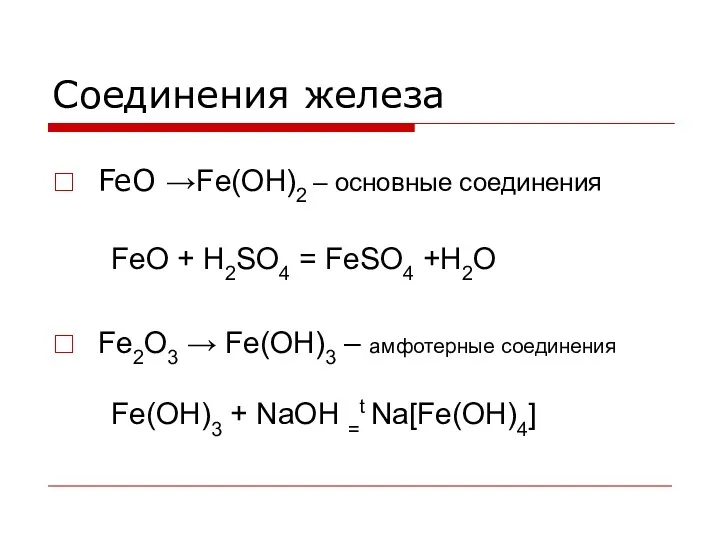
Соединения железа
FeO →Fe(OH)2 – основные соединения
FeO + H2SO4 = FeSO4
+H2O
Fe2O3 → Fe(OH)3 – амфотерные соединения
Fe(OH)3 + NaOH =t Na[Fe(OH)4]
Слайд 14

Качественные реакции
На ион Fe2+ - взаимодействие с красной кровяной солью гексацианоферратом
(III)калия
Fe+2SO4+K3[Fe(CN)6]=KFe+3[Fe+2(CN)6]↓+K2SO4
синего цвета
На ион Fe3+–взаимодействие с роданидом аммония
Fe+3CI3+3NH4SCN↔Fe(SCN)3↓+3NH4CI
кроваво-красного
цвета













 Лесная аптека. Викторина
Лесная аптека. Викторина Соборы Санкт-Петербурга
Соборы Санкт-Петербурга Презентация для внеурочной деятельности Подарок для мамы
Презентация для внеурочной деятельности Подарок для мамы Желе, виды желе в зависимости от желирующего вещества. Правила их режима варки
Желе, виды желе в зависимости от желирующего вещества. Правила их режима варки Проект :Железо - элемент жизни
Проект :Железо - элемент жизни Методы и проблемы оценивания угроз безопасности. Стандарты информационной безопасности
Методы и проблемы оценивания угроз безопасности. Стандарты информационной безопасности Том 1 романа Л.Н.Толстого Война и мир
Том 1 романа Л.Н.Толстого Война и мир Ерте жыныстық жетілу профилактикасы
Ерте жыныстық жетілу профилактикасы Что такое диод
Что такое диод презентация Формы взаимодействия с родителями
презентация Формы взаимодействия с родителями Формирование доброжелательных отношений среди дошкольников
Формирование доброжелательных отношений среди дошкольников Разработка технологического процесса изготовления детали Крышка
Разработка технологического процесса изготовления детали Крышка Удивительные деревья мира
Удивительные деревья мира Миграция факторов производства
Миграция факторов производства духовно - нравственное воспитание
духовно - нравственное воспитание Веселые старты
Веселые старты Тест по технологии
Тест по технологии Игра по УМКНинди?
Игра по УМКНинди? Организационные структуры управления
Организационные структуры управления Процесуальний порядок проведення технічної інвентаризації об’єктів нерухомого майна (Тема 4)
Процесуальний порядок проведення технічної інвентаризації об’єктів нерухомого майна (Тема 4) Моделирование геологических объектов с применением технологии пассивной магнитно-резонансной локации недр
Моделирование геологических объектов с применением технологии пассивной магнитно-резонансной локации недр Схема расстановки сил и средств при проведении показного пожарно-тактического учения на здание торгового центра Калина
Схема расстановки сил и средств при проведении показного пожарно-тактического учения на здание торгового центра Калина Презентация к уроку Семяя в православной традиции
Презентация к уроку Семяя в православной традиции Презентация Кубанский казачий хор
Презентация Кубанский казачий хор ВТВП 01 Феномен воздействия
ВТВП 01 Феномен воздействия История варежки
История варежки Право, его роль в жизни общества и государства
Право, его роль в жизни общества и государства Визитка команды педагогов Дружба на муниципальном методическом ринге ФГТ дошкольного образования
Визитка команды педагогов Дружба на муниципальном методическом ринге ФГТ дошкольного образования