Слайд 2

Цели урока:
1. Познакомить учащихся с законом сохранения массы веществ; создать условия
для формирования у учащихся понятий «уравнение химической реакции», «признаки реакции»;
2. Способствовать формированию навыков определения признаков реакции, составления уравнений химических реакций и расстановки коэффициентов;
3. Содействовать обогащению словарного запаса, творческих способностей учащихся
Слайд 3

Подчеркнуть химические явления. Указать признаки химических реакций.
скисание молока,
подгорание пищи на
сковороде,
испарение жидкой ртути,
почернение серебряных изделий,
образование тумана,
испарение воды,
образование ржавчины,
горение древесины,
таянье льда,
кипение воды,
Слайд 4

Закон сохранения массы веществ
Масса веществ, вступивших в химическую реакцию, равна
массе веществ, получившихся в результате реакции.
(современная формулировка)
Слайд 5

Слайд 6

М.В. Ломоносов, 1756 г.
«Все перемены в натуре случающиеся такого суть состояния,
что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет...»
Слайд 7

Спустя 41 год после опытов Ломоносова французский учёный Антуан Лоран Лавуазье
практически повторил формулировку закона в своём учебнике.
Слайд 8

Уравнение химической реакции
Это условная запись химической реакции с помощью химических формул
и математических знаков
2 Са + O2 ? 2СаO
коэффициент индекс
Исходные вещества Продукты реакции
Качественная характеристика – какие вещества вступают в реакцию и какие образуются
Количественная характеристика – в каком количестве реагируют вещества, какое количество продуктов реакции
Слайд 9

Правило
В соответствии с законом сохранения массы веществ число атомов каждого
элемента в левой и правой частях уравнения химической реакции должно быть одинаковым.
2Са + O2 ? 2 СаO
2 атома кальция и 2 атома кислорода
Слайд 10

Составление уравнений реакций (алгоритм)
Запишите формулы исходных веществ, соединив их знаком «плюс»,
и поставьте стрелку Na+ Cl2 ?
Запишите после стрелки формулы продуктов реакции Na + Cl2 ? NaCl
Расставьте коэффициенты так, чтобы число атомов каждого химического элемента в левой и правой частях уравнения было одинаково 2 Na + Cl2 ? 2 NaCl
Слайд 11
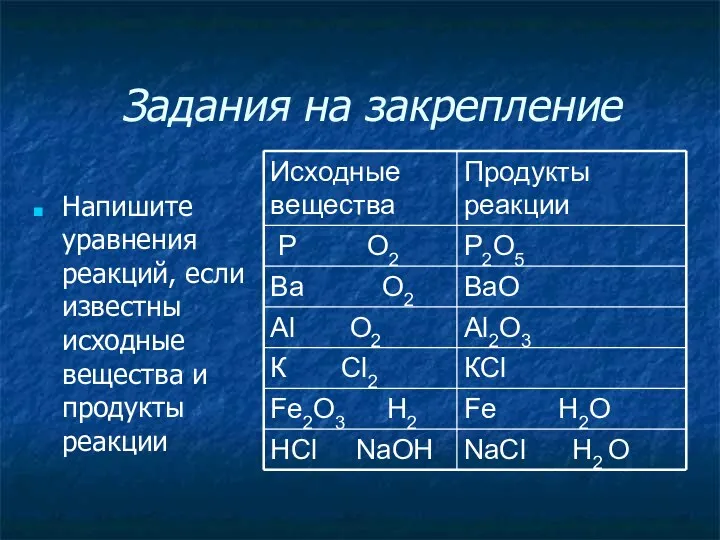
Задания на закрепление
Напишите уравнения реакций, если известны исходные вещества и продукты
реакции
Слайд 12

Расставьте коэффициенты в уравнениях реакции.
1. Cu + O2 → CuO
2. HCl
→ H2 +Cl2
3. Ag2O + C → Ag +CO2
4. ZnO + HNO3 → Zn(NO3)2 + H2O
Слайд 13

Слайд 14

Составьте уравнения реакций по названию веществ. Расставьте коэффициенты.
Цинк + хлорид
водорода = хлорид цинка + водород
Калий + сера = сульфид калия
Хлорид алюминия = алюминий + хлор
Слайд 15

Слайд 16
















 Off activities
Off activities Информация, свойства, системы счисления, измерение и представление текстовой и графической информации
Информация, свойства, системы счисления, измерение и представление текстовой и графической информации Основні положення законодавства України щодо внутрішнього переміщення та захисту прав людини ВПО
Основні положення законодавства України щодо внутрішнього переміщення та захисту прав людини ВПО Основные элементы налога
Основные элементы налога Антиген
Антиген Изображение и обозначение резьбы
Изображение и обозначение резьбы Страны Западной и Центральной Африки. Нигерия
Страны Западной и Центральной Африки. Нигерия Развитие фонематического слуха у детей старшего дошкольного возраста
Развитие фонематического слуха у детей старшего дошкольного возраста Математика. Теория вероятностей
Математика. Теория вероятностей Наблюдения и опыты
Наблюдения и опыты Открытое собрание студенческого совета ХТФ для I курса
Открытое собрание студенческого совета ХТФ для I курса Современные строительные материалы
Современные строительные материалы Конфликты человеческой души: интрапсихическая интерпретация
Конфликты человеческой души: интрапсихическая интерпретация матем 15.02
матем 15.02 Цифровые многоканальные телекоммуникационные системы
Цифровые многоканальные телекоммуникационные системы Составление программ рисования графических объектов в ЛогоМирах
Составление программ рисования графических объектов в ЛогоМирах Презентация по подготовке к проведению сейсморазведочных работ в Аральском море
Презентация по подготовке к проведению сейсморазведочных работ в Аральском море Растениеводство в нашем крае. 4 класс
Растениеводство в нашем крае. 4 класс Игра Ребусы. Животные
Игра Ребусы. Животные Медициналық қызмет көлемі және құрылысы
Медициналық қызмет көлемі және құрылысы Музей Метрополитен Нью Йорк
Музей Метрополитен Нью Йорк Көшбасшылық психологиясы
Көшбасшылық психологиясы Конструкция: часть и целое. Здание как сочетание различных объемов. Понятие модуля. 8 класс
Конструкция: часть и целое. Здание как сочетание различных объемов. Понятие модуля. 8 класс Разработка классного часа. Построим дом счастья.
Разработка классного часа. Построим дом счастья. Система счисления
Система счисления Кубанская область и Черноморская губерния (1900 - 1920)
Кубанская область и Черноморская губерния (1900 - 1920) Задача выбора предпочтительного рыночного портфеля предприятия. Тема 5
Задача выбора предпочтительного рыночного портфеля предприятия. Тема 5 Внеклассное мероприятие с мультимедийной презентацией Тема: Пионеры – герои
Внеклассное мероприятие с мультимедийной презентацией Тема: Пионеры – герои