Содержание
- 2. Тем урока: «Азотная кислота» Цели урока: изучение способов получения, физических и химических свойств азотной кислоты, отметив
- 3. Получение азотной кислоты Её папа – Оксид азота (IV) был мужчина злого нрава и носил прозвище
- 4. Получение азотной кислоты В промышленности – окислением аммиака: 4NH3 + 5O2 = 4NO + 6H2O 2NO
- 5. Физические свойства Бесцветная жидкость, дымящая на воздухе. Едкий запах. Желтый цвет концентрированной кислоты (разложение с образованием
- 6. Химические свойства Разбавленная азотная кислота проявляет свойства, общие для всех кислот: Диссоциация в водном растворе: Реакция
- 7. 3Cu + 8HNO3(раз) = 3Cu(NO3)2 + 2NO + 4H2O Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2
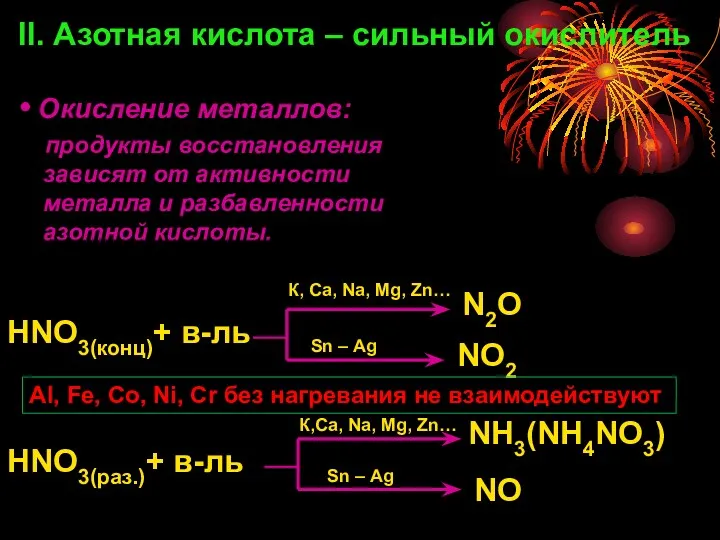
- 8. Окисление металлов: продукты восстановления зависят от активности металла и разбавленности азотной кислоты. HNO3(конц)+ в-ль II. Азотная
- 9. Химические свойства Разбавленная азотная кислота проявляет свойства, общие для всех кислот: Диссоциация в водном растворе: HNO3
- 10. Закрепление изученного материала 1. Составьте уравнения практически осуществимых реакций азотной кислоты с веществами, формулы которых: а)
- 12. Скачать презентацию








 Натюрморт_Истории из жизни вещей
Натюрморт_Истории из жизни вещей Дифференциация задержки психического развития от сходных состояний
Дифференциация задержки психического развития от сходных состояний Игра как ведущий вид деятельности детей дошкольного возраста. Современные технологии
Игра как ведущий вид деятельности детей дошкольного возраста. Современные технологии Peek-a-Boo
Peek-a-Boo Автоматизация звука Р.
Автоматизация звука Р. ПРЕЗЕНТАЦИЯ ВСЕ РАБОТЫ ХОРОШИ-ВЫБИРАЙ НА ВКУС
ПРЕЗЕНТАЦИЯ ВСЕ РАБОТЫ ХОРОШИ-ВЫБИРАЙ НА ВКУС Профессиональные стандарты
Профессиональные стандарты Презентация Первые школы на Руси
Презентация Первые школы на Руси Конституция России
Конституция России Позиционирование ампайров и винг-ампайров в матчевых гонках (Umpires’ Positioning)
Позиционирование ампайров и винг-ампайров в матчевых гонках (Umpires’ Positioning) Политическая культура
Политическая культура Городское и сельское население. Урбанизация, как всемирный процесс. Экономическая и социальная география мира. (10 класс)
Городское и сельское население. Урбанизация, как всемирный процесс. Экономическая и социальная география мира. (10 класс) Синтоизм. Праздник Мацури
Синтоизм. Праздник Мацури Приборы безопасности. Системы обеспечения безопасности движения
Приборы безопасности. Системы обеспечения безопасности движения Дыхание растений. 6 класс
Дыхание растений. 6 класс Образовательная программа Политология
Образовательная программа Политология Австрийская экономическая школа: общий анализ
Австрийская экономическая школа: общий анализ Первичные преобразователи
Первичные преобразователи Презентация Информационно-коммуникационные технологии (ИКТ) в дошкольном образовании
Презентация Информационно-коммуникационные технологии (ИКТ) в дошкольном образовании Хлеб - всему голова
Хлеб - всему голова Презентация для урока биологии на тему: Сельдь. Внешнее и внутреннее строение.
Презентация для урока биологии на тему: Сельдь. Внешнее и внутреннее строение. Разговор о профессиях в средней группе детского сада
Разговор о профессиях в средней группе детского сада Словарик устаревших слов.
Словарик устаревших слов. Острая сердечная недостаточность (ОСН)
Острая сердечная недостаточность (ОСН) Индексирование документов. Определение, основные процессы
Индексирование документов. Определение, основные процессы Конференция Здоровье сберегающие технологии.
Конференция Здоровье сберегающие технологии. Урок-презентация на тему: Письма бывают разные.
Урок-презентация на тему: Письма бывают разные. Три состояния вещества
Три состояния вещества