Содержание
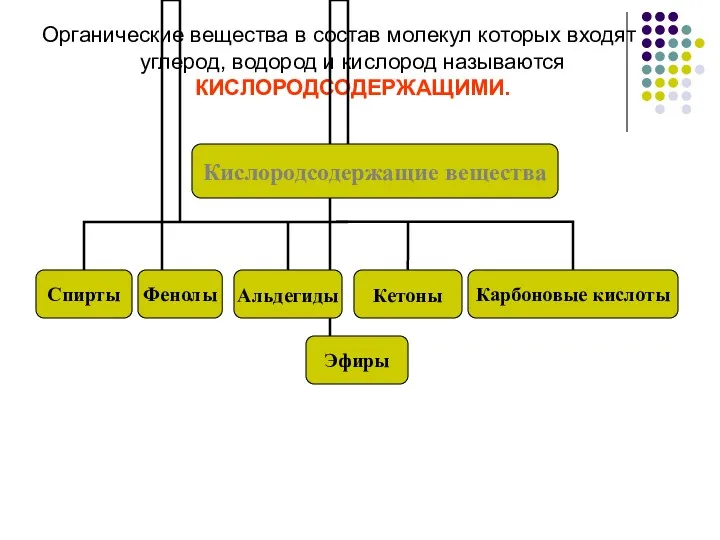
- 2. Органические вещества в состав молекул которых входят углерод, водород и кислород называются КИСЛОРОДСОДЕРЖАЩИМИ.
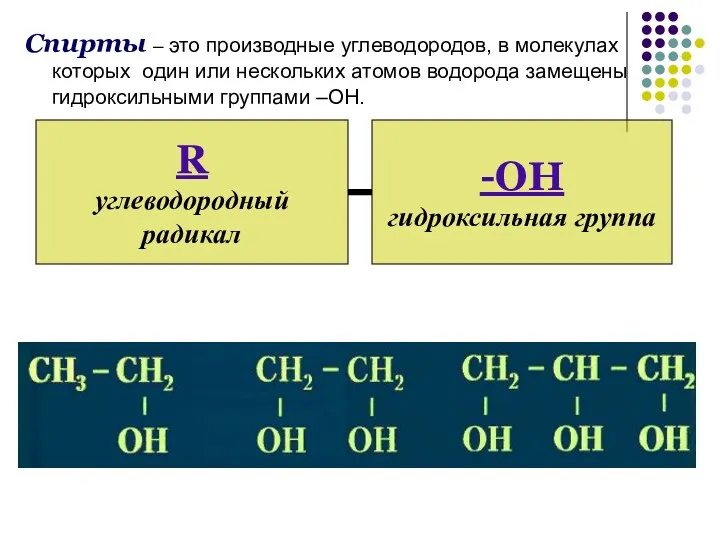
- 3. Спирты – это производные углеводородов, в молекулах которых один или нескольких атомов водорода замещены гидроксильными группами
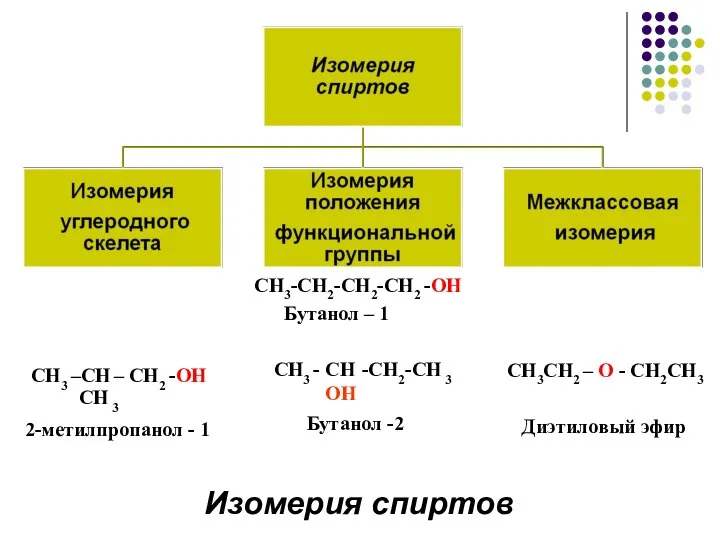
- 4. Номенклатура спиртов выбираем наиболее длинную углеродную цепь, содержащую гидроксильные группы. нумеруем атомы углерода, так чтобы сумма
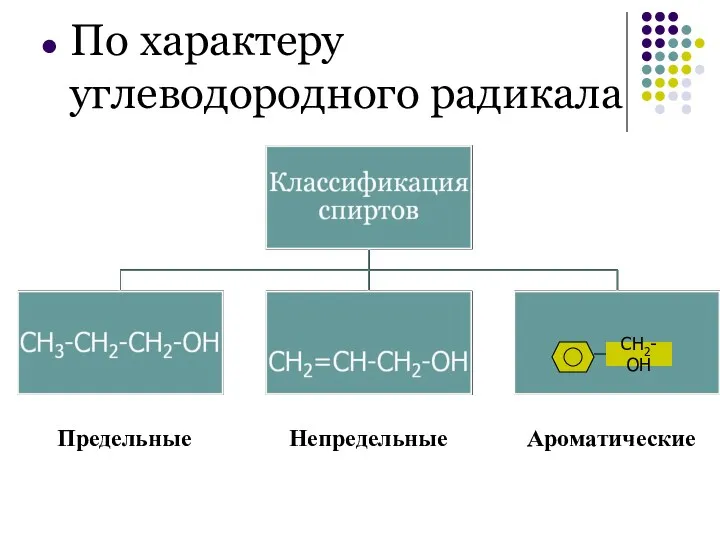
- 5. По характеру углеводородного радикала Предельные Непредельные Ароматические
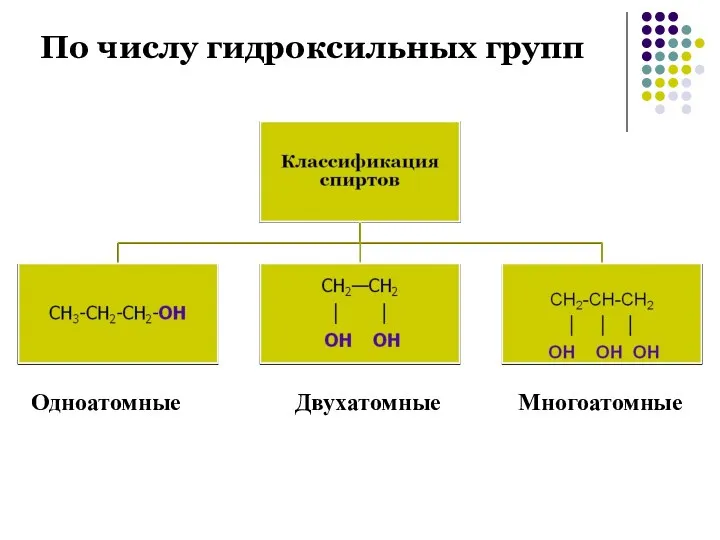
- 6. По числу гидроксильных групп Одноатомные Двухатомные Многоатомные
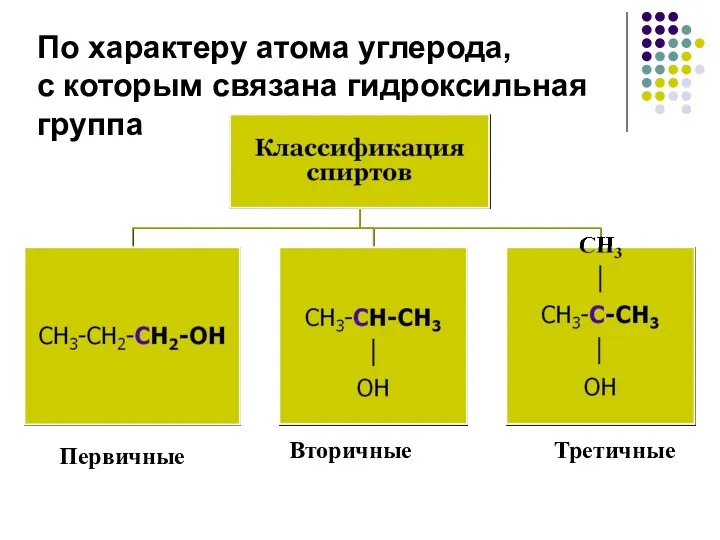
- 7. По характеру атома углерода, с которым связана гидроксильная группа Первичные Вторичные Третичные
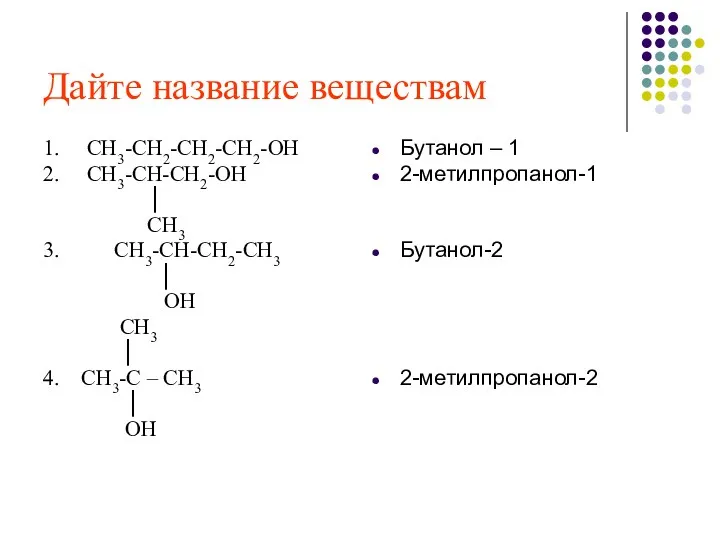
- 8. Дайте название веществам 1. СН3-СН2-СН2-СН2-ОН 2. СН3-СН-СН2-ОН │ СН3 3. СН3-СН-СН2-СН3 │ ОН СН3 │ 4.
- 9. СН3-СН2-СН2-СН2 -ОН Бутанол – 1 СН3 - СН -СН2-СН 3 OH Бутанол -2 СН3 –СН –
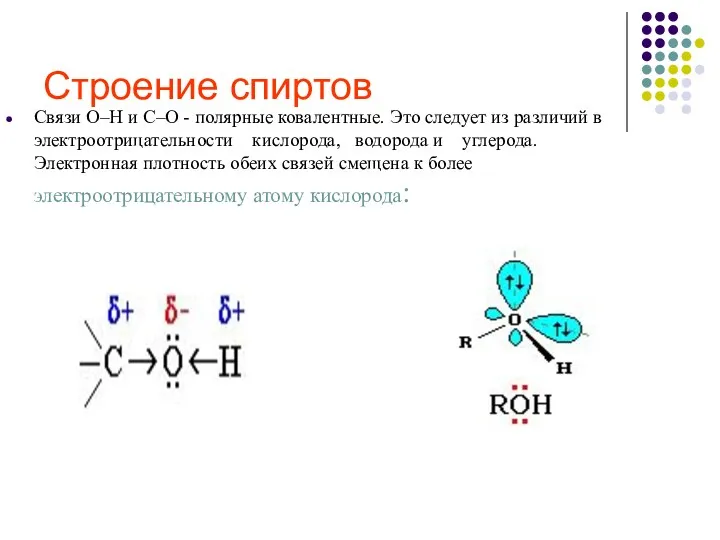
- 10. Строение спиртов Связи О–Н и С–О - полярные ковалентные. Это следует из различий в электроотрицательности кислорода,
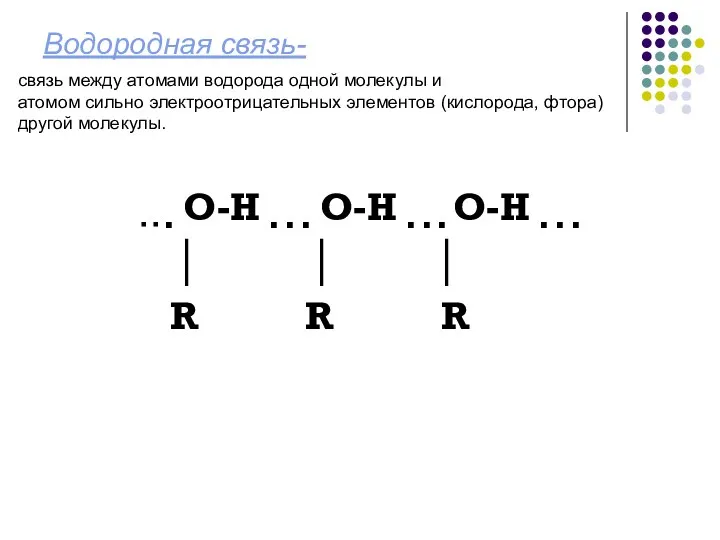
- 11. Водородная связь- ▪ ▪ ▪ О-Н ▪ ▪ ▪ О-Н ▪ ▪ ▪ О-Н ▪ ▪
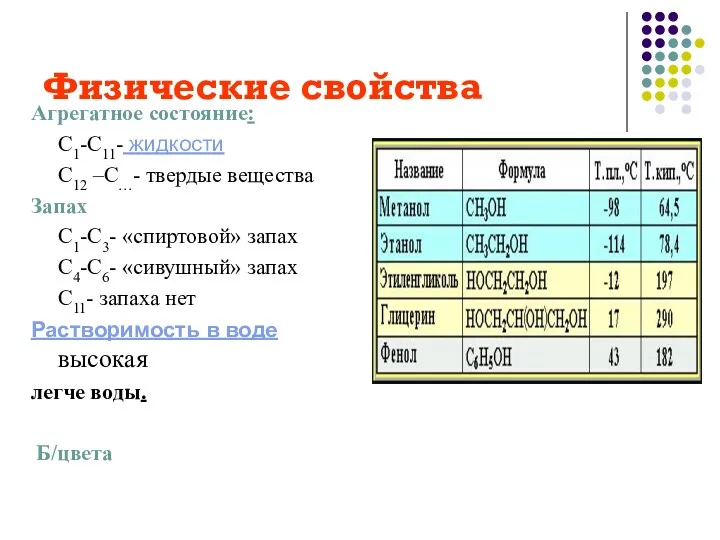
- 12. Физические свойства Агрегатное состояние: С1-С11- жидкости С12 –С…- твердые вещества Запах С1-С3- «спиртовой» запах С4-С6- «сивушный»
- 13. Домашнее задание Параграф 15, записи в тетради, В.1 + изомеры
- 14. Ответьте на вопросы 1. Чем объясняется разница в растворимости этанола и пропанола в воде? 2.Известно, что
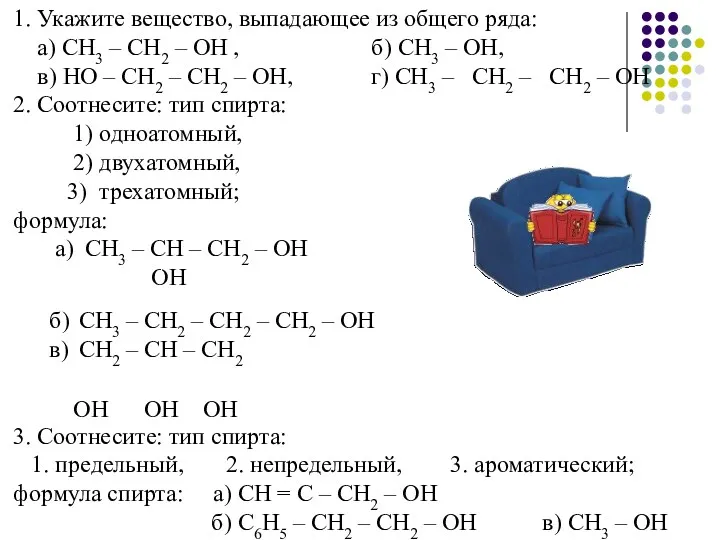
- 15. 1. Укажите вещество, выпадающее из общего ряда: а) СН3 – СН2 – ОН , б) СН3
- 16. 4. Общая формула гомологического ряда предельных одноатомных спиртов: а) СnН2n -1ОН, б) СnН2 n +1ОН, в)
- 17. СН3 8. Название вещества с формулой СН3– СН – С (СН3)2– СН3 ОН а) 3,3-диметилбутанол-2, б)
- 18. Домашнее задание: § 11, вопросы № 1 – 8 (устно); 9,10 (письменно).
- 19. Получение спиртов. 1.Гидратацией алкенов. СН2=СН2+ Н2О →СН3-СН2-ОН 2. Специфические а)Метанола – из синтез – газа СО+2Н2→СН3ОН
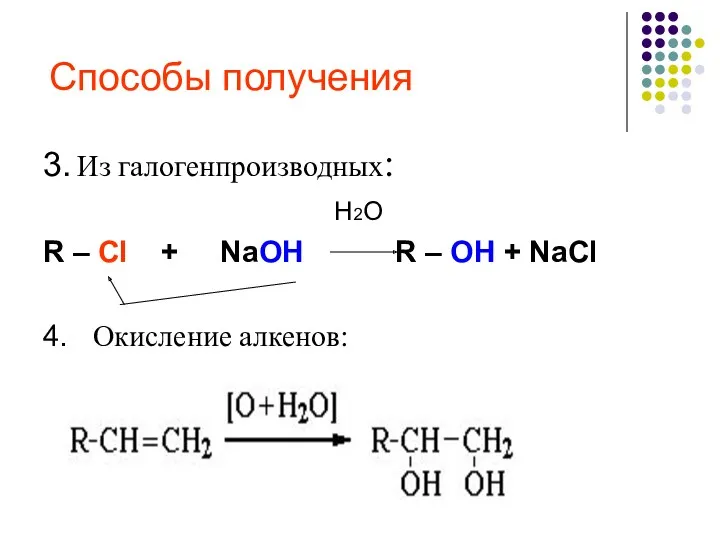
- 20. Способы получения 3. Из галогенпроизводных: H2O R – Cl + NaOH R – OH + NaCl
- 21. Химические свойства спиртов В химических реакциях гидроксисоединений возможно разрушение одной из двух связей: С–ОН с отщеплением
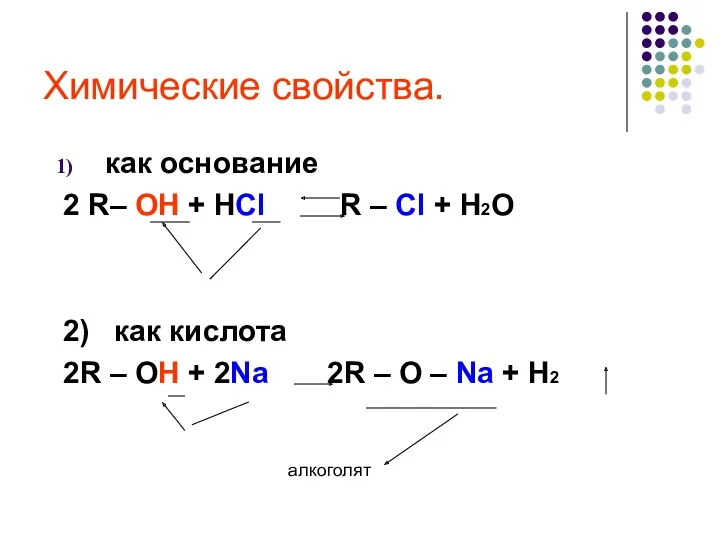
- 22. Химические свойства. как основание 2 R– OH + HCl R – Cl + H2O 2) как
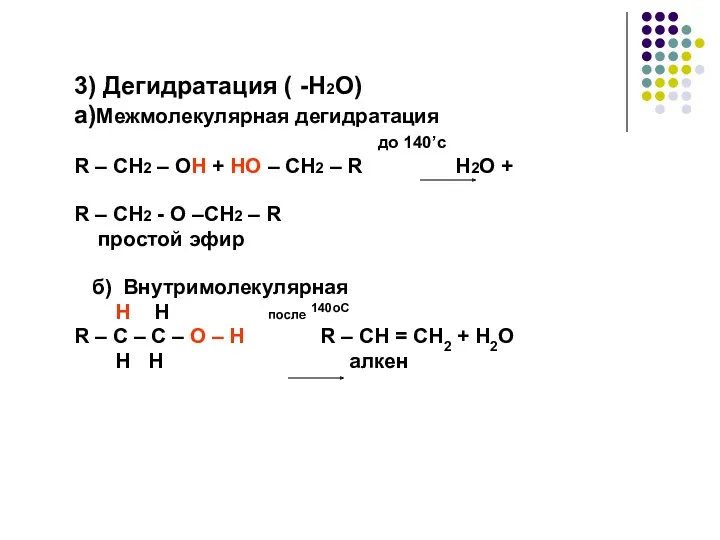
- 23. 3) Дегидратация ( -H2O) a)Межмолекулярная дегидратация до 140’с R – CH2 – OH + HO –
- 24. Реакция этерификации Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима
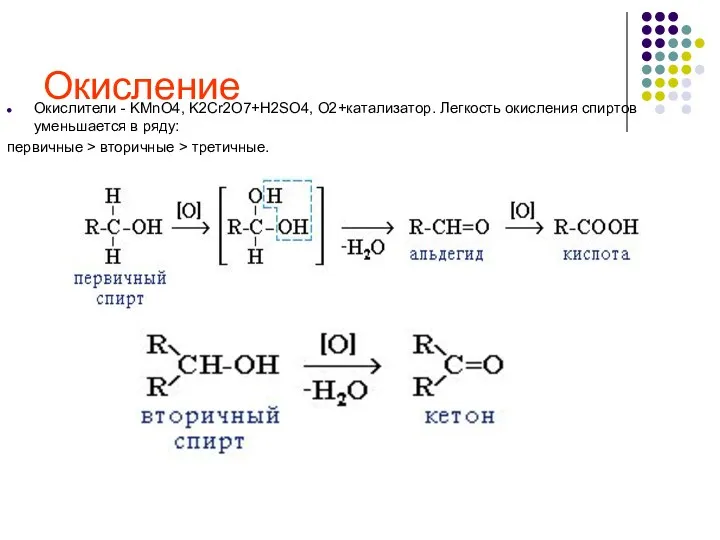
- 25. Окисление Окислители - KMnO4, K2Cr2O7+H2SO4, O2+катализатор. Легкость окисления спиртов уменьшается в ряду: первичные > вторичные >
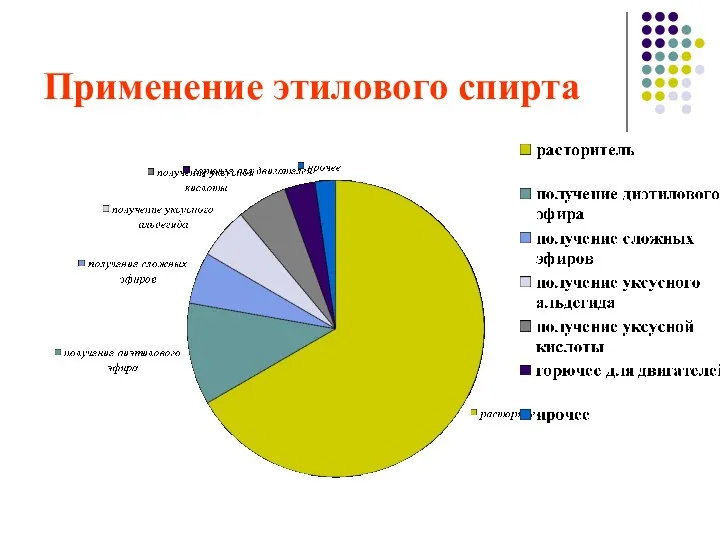
- 26. Применение этилового спирта
- 27. Спирт - ксенобиотик Ксенобиотики – это вещества, которые не содержатся в человеческом организме, но влияют на
- 28. Тестирование http://www.chemistry.ssu.samara.ru/test/ROH.htm
- 30. Скачать презентацию










 Правила технической эксплуатации железных дорог Российской Федерации
Правила технической эксплуатации железных дорог Российской Федерации Декупаж
Декупаж Классификация средств измерений
Классификация средств измерений Ценообразование. Предмет, метод и задачи курса
Ценообразование. Предмет, метод и задачи курса Мониторинг и оценка эффективности наставничества участниками проекта Формула жизни
Мониторинг и оценка эффективности наставничества участниками проекта Формула жизни Дерево целей и систем автомобильного транспорта и технической эксплуатации. Понятие о дереве целей. Тема 4
Дерево целей и систем автомобильного транспорта и технической эксплуатации. Понятие о дереве целей. Тема 4 Конструирование одежды
Конструирование одежды Гиганты прошлого
Гиганты прошлого Основная ткань
Основная ткань Теории и технологии обучения
Теории и технологии обучения Правила технической эксплуатации железных дорог Российской Федерации, часть 2
Правила технической эксплуатации железных дорог Российской Федерации, часть 2 Сказочный домик
Сказочный домик Календарные Христианские праздники
Календарные Христианские праздники Презентация к программе внеурочной деятельности Бурейские родники
Презентация к программе внеурочной деятельности Бурейские родники 63715
63715 Сущность, формы и условия развития внешнеэкономических связей (ВЭД)
Сущность, формы и условия развития внешнеэкономических связей (ВЭД) Детские игры - школа здоровья
Детские игры - школа здоровья Реконструкция подстанции 110/10 кВ с разработкой релейной защиты силового трансформатора
Реконструкция подстанции 110/10 кВ с разработкой релейной защиты силового трансформатора Анализ эффективности работы эксплуатационного фонда столбового месторождения
Анализ эффективности работы эксплуатационного фонда столбового месторождения Презентация Дети блокадного Ленинграда
Презентация Дети блокадного Ленинграда Средняя общеобразовательная школа на 450 ученических мест в г. Краснослободске
Средняя общеобразовательная школа на 450 ученических мест в г. Краснослободске Физика поверхностных явлений. Свойства растворов
Физика поверхностных явлений. Свойства растворов Рождественский венок
Рождественский венок Презентация Использование технологии дидактического синквейна в работе со старшими дошкольниками с ОНР
Презентация Использование технологии дидактического синквейна в работе со старшими дошкольниками с ОНР Нормативно-правовые акты, регулирующие материальную и нематериальную мотивацию государственных гражданских служащих России
Нормативно-правовые акты, регулирующие материальную и нематериальную мотивацию государственных гражданских служащих России Погода - условия обитания человека.
Погода - условия обитания человека. Использование информационных технологий
Использование информационных технологий Слайд-презентация проекта Детский сад наш хорош, лучше сада не найдешь!
Слайд-презентация проекта Детский сад наш хорош, лучше сада не найдешь!