Слайд 2Выполните упражнения.
Закончите уравнения возможных реакций. Запишите уравнения в молекулярном и ионном виде:
NaOH +
CuCl2 →
AgNO3 + LiCl →
NaNO3 + HCl →
CaCO3 + H2SO4 →
Слайд 3Ответьте на вопросы.
Какие реакции называются ионными?
Какие уравнения реакций называются ионными?
Какие существуют правила написания
ионных уравнений реакций?
Слайд 4Кислоты в свете ТЭД.
Кислоты с точки зрения ТЭД – это электролиты, которые при
диссоциации образуют катионы водорода и анионы кислотного остатка.
Слайд 5Общие свойства кислот.
Кислый вкус.
Изменение окраски индикаторов.
Разъедают растительные и животные ткани.
Слайд 6Классификация кислот.
1. По агрегатному состоянию:
Слайд 7Классификация кислот.
2. По наличию кислорода в кислотном остатке.
Слайд 8Классификация кислот.
3. По основности (по количеству атомов водорода):
Слайд 9Классификация кислот.
4. По растворимости в воде:
Слайд 10Классификация кислот.
5. По летучести:
Слайд 11Классификация кислот.
6. По степени электролитической диссоциации:
Слайд 12Классификация кислот.
7. По стабильности:
Слайд 13Закрепление.
Дайте классификацию серной кислоте по всем известным признакам классификации.
Напишите уравнение диссоциации серной кислоты.
Слайд 14Химические свойства кислот.
1. Кислота + основание → соль + вода
(реакция нейтрализации), (реакция
обмена)
HNO3 + NaOH → NaNO3 + H2O
H+ + OH- → H2O
2HCl + Fe(OH)2 → FeCl2 + 2H2O
2H+ + Fe(OH)2 → Fe+2 + 2H2O
Слайд 15Химические свойства кислот.
2. Кислота+оксид металла→ соль+вода
(реакция обмена)
СuO + H2SO4 → CuSO4
+ H2O
СuO +2H+ → Cu+2 + H2O
Слайд 16Химические свойства кислот.
3. Кислота + металл → соль + водород
(реакция замещения)
Чтобы прошла
эта реакция, необходимо выполнить несколько условий:
1. Металл должен находиться в ряду напряжений до водорода.
Zn + 2HCl → ZnCl2 + H2↑
Cu + HCl → не идёт
Слайд 17Химические свойства кислот.
2. Должна получиться растворимая соль.
Pb + H2SO4 → PbSO4↓ +
H2↑ -
образующаяся соль покрывает поверхность металла защитной плёнкой и реакция прекращается.
3. Эта реакция характерна для растворов кислот, поэтому нерастворимые кислоты не вступают в реакции с металлами.
Zn + H2SiO3 → не идёт
Слайд 18Химические свойства кислот.
4. Концентрированный раствор серной кислоты и раствор азотной кислоты любой концентрации
взаимодействуют с металлами иначе, поэтому уравнения реакций между металлами и этими кислотами записываются по другой схеме:
H2SO4(разб.) + Ме(до Н2) → соль + водород
Слайд 19Химические свойства кислот.
4. Кислота + соль →
→ новая кислота + новая
соль
(Если образуется осадок или газ) (реакция обмена)
H2SO4 + BaCl2 → BaSO4↓+ 2HCl
SO42- + Ba2+ → BaSO4↓
2HCl + CaCO3 → CaCl2 + H2O + CO2↑
2H+ + CaCO3 → Ca2+ + H2O + CO2↑
Слайд 20Закрепление.
Напишите уравнения реакций взаимодействия серной кислоты с:
Гидроксидом магния.
Сульфатом меди.
Оксидом натрия.
Магнием.
 Путешествие в страну Здоровья
Путешествие в страну Здоровья Основы конституционного строя Российской Федерации
Основы конституционного строя Российской Федерации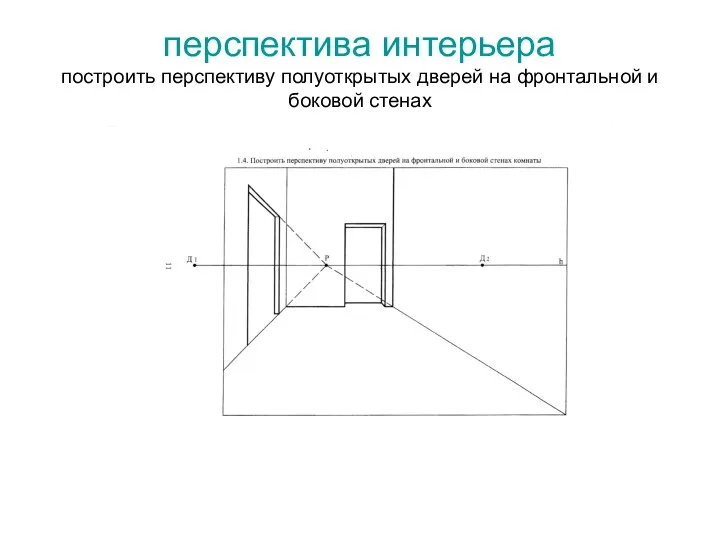 Перспектива интерьера. Построить перспективу полуоткрытых дверей на фронтальной и боковой стенах
Перспектива интерьера. Построить перспективу полуоткрытых дверей на фронтальной и боковой стенах Федор Михайлович Достоевский Преступление и наказание. Основные причины преступления Родиона Раскольникова
Федор Михайлович Достоевский Преступление и наказание. Основные причины преступления Родиона Раскольникова Великий русский ученый. Материалы о жизни и творчестве М.В. Ломоносова к 310-летию со дня рождения
Великий русский ученый. Материалы о жизни и творчестве М.В. Ломоносова к 310-летию со дня рождения Семенные растения
Семенные растения Малярные работы
Малярные работы Представление о красоте человека
Представление о красоте человека Портфолио воспитателя
Портфолио воспитателя Школа бюрократической организации труда М. Вебера
Школа бюрократической организации труда М. Вебера Османська Імперія
Османська Імперія Автоматизированные системы управления
Автоматизированные системы управления Клуб молодого предпринимателя Капитаны России
Клуб молодого предпринимателя Капитаны России Направления современной музыки
Направления современной музыки Школа реальных дел. Конкурс проектов и прикладных исследований школьников на основе реальных задач работодателей
Школа реальных дел. Конкурс проектов и прикладных исследований школьников на основе реальных задач работодателей Енергозберігаючі технології в процесі переробки органічних відходів шляхом метаногенеза у біодобрива та біогаз
Енергозберігаючі технології в процесі переробки органічних відходів шляхом метаногенеза у біодобрива та біогаз Сказка- ложь, да в ней намёк...!
Сказка- ложь, да в ней намёк...! Drywall (Gypsum Board) factory in Central Asia
Drywall (Gypsum Board) factory in Central Asia методическая разработка раздела программы Внутренние воды России
методическая разработка раздела программы Внутренние воды России презентация бусы.
презентация бусы. Текстильная мебель
Текстильная мебель Гидрографическое и водохозяйственное районирование территории РФ
Гидрографическое и водохозяйственное районирование территории РФ Advanced web fuzzing today. Веб-сканеры их преимущества и недостатки
Advanced web fuzzing today. Веб-сканеры их преимущества и недостатки Методология научного и технического творчества
Методология научного и технического творчества Первый онлайн тотализатор
Первый онлайн тотализатор Художественный фильм режиссёра Франко Дзеффирелли Ромео и Джульетта
Художественный фильм режиссёра Франко Дзеффирелли Ромео и Джульетта Мотивы плохого поведения.
Мотивы плохого поведения. Повторение теории и решение тригонометрических уравнений в рамках подготовки к ЕГЭ
Повторение теории и решение тригонометрических уравнений в рамках подготовки к ЕГЭ