презентация Положение металлов в периодической системе химических элементов Д.И. Менделеева. Физические свойства металлов
Содержание
- 2. Рассмотреть положение металлов в Периодической системе химических элементов Д.И.Менделеева, особенности строения их атомов. Повторить и обобщить
- 3. 1.Перечислить щелочные металлы и составить их электронные формулы. 2. Почему щелочные металлы проявляют сильные восстановительные свойства?
- 4. 5. Почему бериллий обладает амфотерными свойствами? 6. К металлам относят также элементы главной подгруппы 3 группы(
- 5. 1. Небольшое число электронов на последнем энергетическом уровне ( 1-3) 2. Относительно большой атомный радиус (
- 6. Из этих двух особенностей металлов вытекает их основное свойство – сильная восстановительная способность, способность отдавать внешние
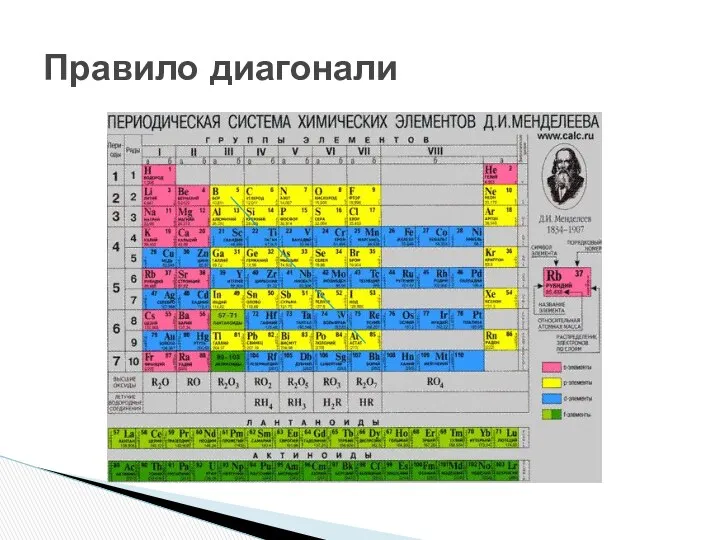
- 7. Правило диагонали
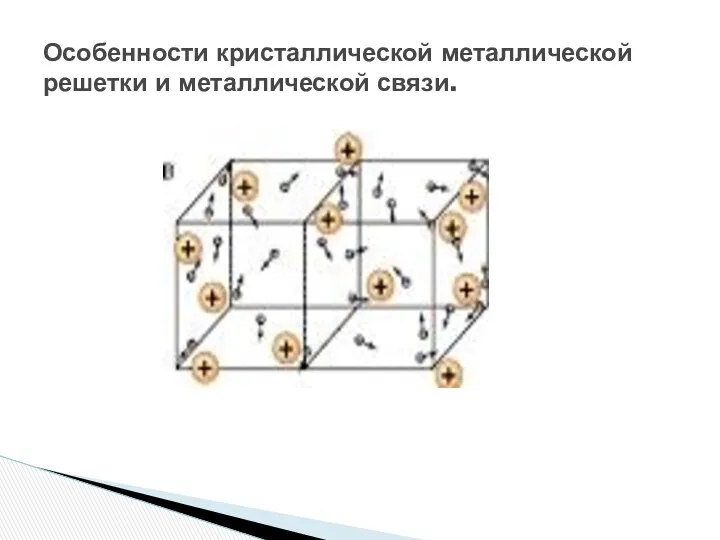
- 8. Особенности кристаллической металлической решетки и металлической связи.
- 9. Катионы и атомы постоянно переходят друг в друга, благодаря свободному перемещению электронов. Эти процессы происходят непрерывно.
- 10. Физические свойства металлов.
- 11. Общие физические свойства металлов определяются металлической связью и металлической кристаллической решеткой. Все металлы при обычных условиях
- 13. Результат отражения световых лучей. Они характерны для компактного состояния металла и гладкой его поверхности. В мелко
- 14. Электропроводность металлов обусловлена наличием в металлической кристаллической решетке свободных электронов. С повышением температуры э.п. металлов понижается,
- 16. Hg Pb Fe Zn Mg AI Au Cu Ag В этом ряду электропроводность и теплопроводность металлов
- 17. Если металл плавится при температуре ниже 1000 С его называют легкоплавким, если выше – тугоплавким. Самый
- 18. Вольфрам
- 19. Самые мягкие металлы щелочные и свинец. Они режутся ножом. Причем сверху вниз по периодической системе мягкость
- 20. По плотности металлы делятся на легкие и тяжелые. Если плотность металла меньше 5 г/см, его называют
- 21. Самый легкий и самый тяжелый металл
- 22. При механическом воздействии на кристалл металла происходит смещение слоев атомов, но благодаря свободному перемещению электронов по
- 26. Скачать презентацию





















 Пандемия COVID-19
Пандемия COVID-19 Подольские курсанты
Подольские курсанты Южный и северный полюс
Южный и северный полюс АДАПТАЦИЯ ОРГАНИЗМА ЧЕЛОВЕКА К ФАКТОРАМ СРЕДЫ.
АДАПТАЦИЯ ОРГАНИЗМА ЧЕЛОВЕКА К ФАКТОРАМ СРЕДЫ. пасхальные праздники
пасхальные праздники Обеспечение информационной безопасности. Содержание и структура понятия. (Тема 2)
Обеспечение информационной безопасности. Содержание и структура понятия. (Тема 2) Finland. Финляндия
Finland. Финляндия Корисні копалини
Корисні копалини Дезинфицирующие средства для поверхностей
Дезинфицирующие средства для поверхностей Стигматизация в психиатрии
Стигматизация в психиатрии Veselaya_Azbuka_11_10_14
Veselaya_Azbuka_11_10_14 Ценные бумаги в финансовом менеджменте. Часть 3
Ценные бумаги в финансовом менеджменте. Часть 3 Могул. Техники катания по буграм
Могул. Техники катания по буграм Родительское собрание на тему Права ребёнка - обязанности родителей
Родительское собрание на тему Права ребёнка - обязанности родителей Достопримечательности Европы
Достопримечательности Европы Системный таймер
Системный таймер Презентация к родительскому собранию Права и обязанности родителей
Презентация к родительскому собранию Права и обязанности родителей Маркетинговые исследования в управлении фирмой
Маркетинговые исследования в управлении фирмой Психофизиологические особенности современных школьников: что необходимо учитывать при подготовке к уроку?
Психофизиологические особенности современных школьников: что необходимо учитывать при подготовке к уроку? Размещение отраслей топливно-энергетического комплекса
Размещение отраслей топливно-энергетического комплекса Схема территориального размещения участников промышленного кластера
Схема территориального размещения участников промышленного кластера Трансформаторы тока и напряжения
Трансформаторы тока и напряжения Механізм попередження дискримінації деяких категорій осіб
Механізм попередження дискримінації деяких категорій осіб Новые и Сверхновые Звёзды
Новые и Сверхновые Звёзды Основы функционирования пищеварительного конвейера
Основы функционирования пищеварительного конвейера Первое чудо Иисуса Христа в Кане Галилейской
Первое чудо Иисуса Христа в Кане Галилейской Свистящие и шипящие звуки. Комплексы упражнений
Свистящие и шипящие звуки. Комплексы упражнений Координация деятельности правоохранительных органов по борьбе с преступностью
Координация деятельности правоохранительных органов по борьбе с преступностью