Содержание
- 2. На пути совершенствования мастерства педагога… Учитель химии и экологии МОУ СОШ №2с. Гизель РСО-Алания Саркисян Эмма
- 3. Наша школа.
- 4. ….Вместе дружная семья.
- 5. Эмма Арутюновна Саркисян работает в СОШ №2 им. Д.Доева с.Гизель с 1996 года. Имеет первую квалификационную
- 6. Эмма Арутюновна Саркисян / из ходатайства МО УО Пригородного района/ «Отлично знает предмет и методику преподавания,
- 7. Систематически работает над совершенствованием своего педагогического мастерства путем передового опыта, и сама делится опытом своей работы,
- 8. Пути и методы реализации воспитательной задачи в образовательном процессе. • Система преподавания химии и экологии как
- 9. Подготовка к практикуму… Правильный подбор реактивов и методик – залог успеха в проведении эксперимента.
- 10. Демонстрационный эксперимент – неотъемлемая часть урока.
- 11. Идёт урок.
- 12. Нетрадиционные формы уроков. Урок – сказка. Урок – путешествие. Урок – игра.
- 13. Инновационные технологии на уроках химии. Изложение нового материала с использованием интерактивной доски.
- 14. Инновационные технологии на уроках химии. Использование компьютера для обобщения пройденного материала.
- 15. ЩЕЛОЧНЫЕ МЕТАЛЛЫ общая характеристика
- 16. обучающая: дать общую характеристику щелочных металлов в свете общего, особенного и единичного по трем формам существования
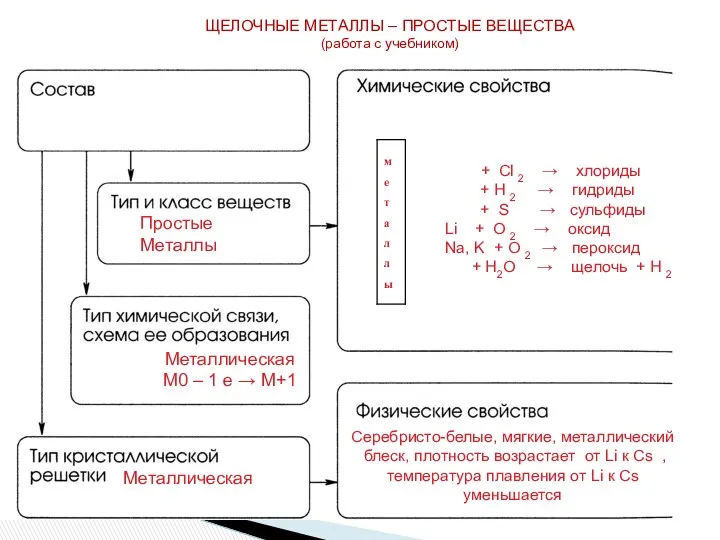
- 17. ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА (работа с учебником) Простые Металлы Металлическая М0 – 1 е →
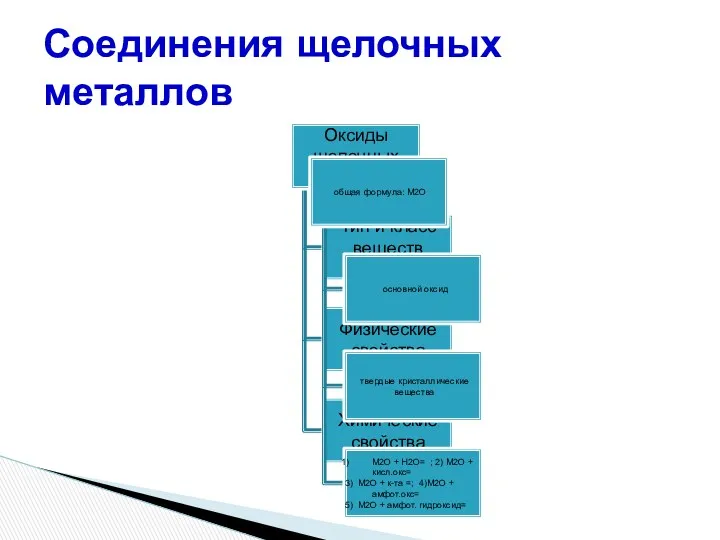
- 18. Соединения щелочных металлов
- 19. Проверь себя (самостоятельная работа ) Дополните схемы взаимодействия щелочных металлов с неметаллами общими формулами и названиями
- 20. Горение натрия Горение лития Распознавание ионов щелочных металлов по окраске пламени
- 21. Тема урока: ГИДРОЛИЗ СОЛЕЙ.
- 22. Ознакомить учащихся с сущностью гидролиза солей. Научить составлять уравнения реакций гидролиза различных солей. Дать представление о
- 23. Пробирки, штативы, спиртовка, растворы индикаторов, HCI, HNO3, NaOH, Na2CO3, AICI3, KNO3, FeCI3, Na2SO4. Оборудование и реактивы:
- 24. Закончить уравнения реакций и написать сокращенные ионные уравнения: Ba(NO3)2 + Na2SO4 KCI + NaOH H2SO4 +
- 25. Лабораторная работа. Исследуйте индикаторами растворы данных солей: Na2CO3, AICI3, KNO3, NH4CN. Изложение нового материала.
- 26. В растворе карбоната натрия: Na2CO3 2 Na+ + CO32- Сущность этого процесса: СO32- + H+OH- HCO3-
- 27. Если Кд кислоты больше Кд основания, среда раствора соли слабокислотная. Если Кд основания больше Кд кислоты,
- 28. Тест. А1. Какова среда раствора, если РН 1. нейтральная 3. кислая 2. щелочная А2. Какая из
- 29. Пожелания моим ученикам Найти себя в жизни. Обрести уверенность в своих силах и возможностях. Идти по
- 31. Скачать презентацию


























 Техническая механика в профессии Архитектор
Техническая механика в профессии Архитектор Виробництво та використання біогазу в Україні та світі (лекція №5 )
Виробництво та використання біогазу в Україні та світі (лекція №5 ) Презентация Социальная защита и реабилитация подростков, совершивших уголовные правонарушения
Презентация Социальная защита и реабилитация подростков, совершивших уголовные правонарушения Знатоки природы
Знатоки природы Курсовая работа (3)
Курсовая работа (3) Бактериальная инфекция СОПР
Бактериальная инфекция СОПР Русский по средам
Русский по средам Карибский кризис
Карибский кризис Центр культуры и истории: перспективы использования здания ул. Нуриманова д. 16
Центр культуры и истории: перспективы использования здания ул. Нуриманова д. 16 must be a good pirate
must be a good pirate Варшапхала_Годовой_гороскоп_для_Дарьи
Варшапхала_Годовой_гороскоп_для_Дарьи Презентация Ты, Кубань, ты наша Родина(часть 2)
Презентация Ты, Кубань, ты наша Родина(часть 2) Велосипедист – водитель транспортного средства
Велосипедист – водитель транспортного средства Геморрагический васкулит у детей
Геморрагический васкулит у детей Викторина по теме Размножение
Викторина по теме Размножение Температура воздуха
Температура воздуха Приборное оборудование вертолета (урок 14)
Приборное оборудование вертолета (урок 14) Respublika_Kongo
Respublika_Kongo ЭОР Игра Дифференциация звуков ЛЬ - Й
ЭОР Игра Дифференциация звуков ЛЬ - Й Методы исследования слуха
Методы исследования слуха ЧС. Основные понятия и классификация
ЧС. Основные понятия и классификация Консультация для воспитателей Применение природного и бросового материала в детском творчестве.
Консультация для воспитателей Применение природного и бросового материала в детском творчестве. Презентация: Автоматизация звук р.
Презентация: Автоматизация звук р. Путешествие по островам природы
Путешествие по островам природы Ревью 070224
Ревью 070224 Современные подходы к проблеме алалии.
Современные подходы к проблеме алалии. Управление исходящим денежным потоком от операционной деятельности в структуре Cash Flow. Тема 3
Управление исходящим денежным потоком от операционной деятельности в структуре Cash Flow. Тема 3 вепсская кукла
вепсская кукла