Содержание
- 2. Задачи урока: Продолжить знакомство с основными понятиями и положениями ТЭД. 2. Отработать умения характеризовать свойства вещества
- 3. С.А. Аррениус- шведский химик. В 1887 году сформулировал основные положения ТЭД. И.А. Каблуков – русский химик.
- 5. Диссоциация солей: K2SO4→ AlCl3→
- 6. Диссоциация щелочей: NaOH→ Ca(OH)2→
- 7. Составить схемы диссоциации кислот: HCl → HNO3→
- 8. Ступенчатая диссоциация многоосновных кислот, кислых и основных солей :
- 9. Диссоциация по трем ступеням возможна в растворе Хлорида алюминия Нитрата алюминия Ортофосфата калия Ортофосфорной кислоты
- 10. Восстановите левую часть для схем ступенчатой диссоциации ортофосфорной кислоты H3PO4 , поставьте соответствующий знак между левой
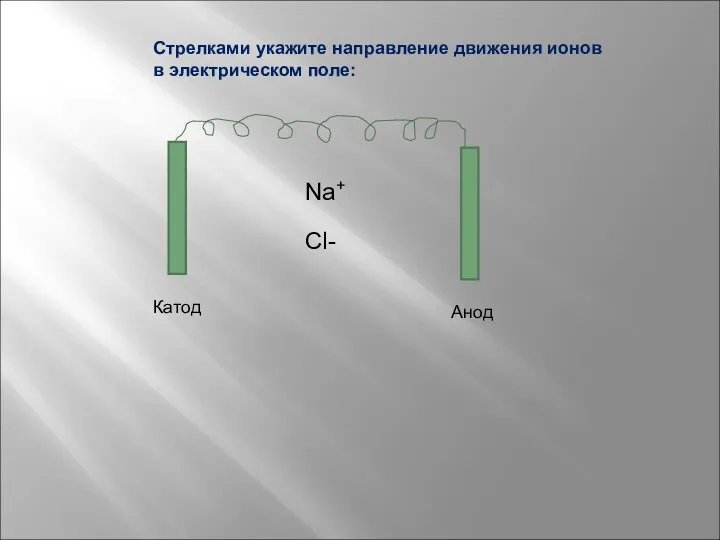
- 11. Na+ Cl- Катод Анод Стрелками укажите направление движения ионов в электрическом поле:
- 12. Что общего у изображенных веществ и что их отличает: HCl 2. CH3COOH 3. HNO3 4. H2
- 13. Составьте формулу для расчета степени диссоциации.
- 14. Электролиты и неэлектролиты Электролитическая диссоциация Диполь, Гидратированный ион Гидратация Катионы и анионы Степень ЭД Слабые и
- 15. Ионы I- образуются при диссоциации а)KIO3 б) KI в) C2H5I г) NaIO4 2. Вещество, при диссоциации
- 16. Д/з: стр. 148-150 учебника О.С.Габриеляна «Химия-11», Всем: №2,3,4 стр.156. *Задача:Определить количество вещества и число ионов натрия,
- 18. Скачать презентацию














 Отставание с разработкой методов лечения и профилактики опасных болезней
Отставание с разработкой методов лечения и профилактики опасных болезней Диагностика воспитанности учащихся
Диагностика воспитанности учащихся В гостях у Хозяйки Медной Горы. Радуга сказок Павла Петровича Бажова.
В гостях у Хозяйки Медной Горы. Радуга сказок Павла Петровича Бажова. Азотная кислота.Нитраты
Азотная кислота.Нитраты Общие сведения о пожарной безопасности технологических процессов производств
Общие сведения о пожарной безопасности технологических процессов производств Развитие сенсорных способностей посредством дидактических игр
Развитие сенсорных способностей посредством дидактических игр Совершенствование организации медицинской помощи населению
Совершенствование организации медицинской помощи населению Электронная физминутка для глаз
Электронная физминутка для глаз Об организации приемной кампании в 1 классы в 2018 году
Об организации приемной кампании в 1 классы в 2018 году Студенческое самоуправление
Студенческое самоуправление Аллергия и беременность
Аллергия и беременность Подготовка к ГИА и ЕГЭ
Подготовка к ГИА и ЕГЭ Для тебя, любимый
Для тебя, любимый Цифровые системы коммутации
Цифровые системы коммутации Үш фазалы асинхронды қозғалтқыштың жұмыс процессі. Асинхронды қозғалтқыштың кернеу өрнектері
Үш фазалы асинхронды қозғалтқыштың жұмыс процессі. Асинхронды қозғалтқыштың кернеу өрнектері Презентация к классному часу Памятные места Старого Оскола
Презентация к классному часу Памятные места Старого Оскола Токарная обработка. Токарные операции
Токарная обработка. Токарные операции Промисловий переворот в Англії
Промисловий переворот в Англії Лексическая тема- Транспорт
Лексическая тема- Транспорт Проектирование промышленных зданий
Проектирование промышленных зданий Информация о стажировке. Компания Halliburton
Информация о стажировке. Компания Halliburton Внеклассное мероприятие: устный журнал Что такое толерантность?
Внеклассное мероприятие: устный журнал Что такое толерантность? День народного единства
День народного единства Экономические задачи повышенного уровня сложности в ЕГЭ
Экономические задачи повышенного уровня сложности в ЕГЭ Презентация по теме Внешнее строение рыб
Презентация по теме Внешнее строение рыб Методический комментарий
Методический комментарий Учение об искуплении
Учение об искуплении Олимпиаданы уткуулунар! 3 класс
Олимпиаданы уткуулунар! 3 класс