Слайд 2

Слайд 3

ЦЕЛИ УРОКА:
дать определение кислотам,
рассмотреть состав кислот,
классифицировать кислоты,
ознакомиться с
формулами и названиями основных неорганических кислот.
Слайд 4

С кислотами нам приходится сталкиваться практически ежедневно.
Кислоты вокруг нас
Слайд 5

Кислоты в животном мире
Есть в муравьях и крапиве невинная,
С пользой для
нас – кислота муравьиная.
Жжет она кожу, но есть в ней и прок –
Ваш ревматизм она вылечит в срок.
Голожаберные моллюски в порядке самообороны выстреливают парами серной кислоты
Тропический паук педипальпида
стреляет во врагов струйкой жидкости,
содержащей 84% уксусной кислоты
Слайд 6

Кислоты в растительном мире
Лишайники выделяют кислоты,
которые разрушают
горные породы.
Мухоморы
в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито, что мухомору незачем прятаться.
Очень популярен в народе щавель,
который содержит щавелевую кислоту.
Слайд 7

Слайд 8

Слайд 9

Слайд 10

Станция - «Дегустационная»
Кислота-кислый
Слайд 11

Станция – «Историческая»
Серная кислота открыта персидским химиком Абубекеру аль Рези.
Угольную
кислоту получил впервые
в конце XVIII в. английский химик
Джозеф Пристли
Слайд 12

Станция - «Информационная».
Слайд 13

HCl, H2SO4, H3PO4
ионы водорода кислотный остаток
(образуют элементы-неметаллы)
Слайд 14

Кислоты Формулы
Азотная кислота HN03
Азотистая кислота HN02.
Серная кислота
H2S04 Сернистая кислота H2S03. Сероводородная кислота H2S
Угольная кислота Н2С03
Кремниевая кислота H2Si03
Фосфорная кислота Н3Р04
Соляная кислота HCI
Слайд 15

Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и
кислотного остатка.
Слайд 16

Кислоты Оксиды
HN03 N203
HN02. N02
H2S04 S03
H2S03. S02
Н2С03 С02
H2Si03 Si02
Н3Р04 Р205
Слайд 17
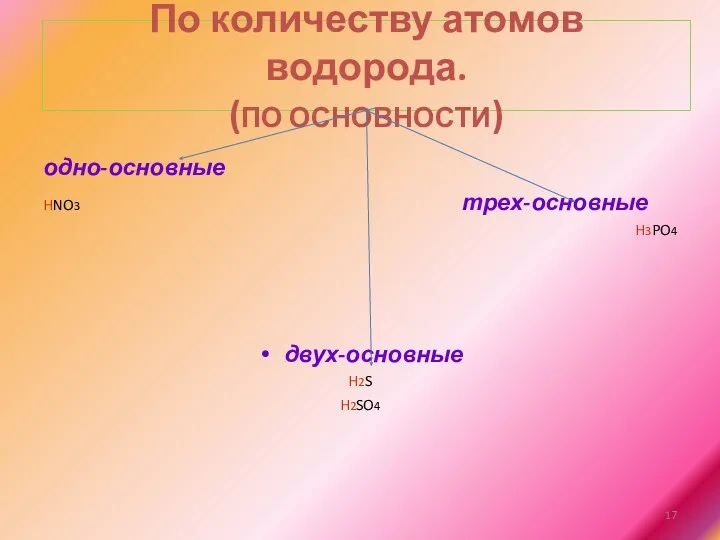
По количеству атомов водорода.
(ПО ОСНОВНОСТИ)
одно-основные
HNO3 трех-основные
H3PO4
двух-основные
H2S
H2SO4
Слайд 18
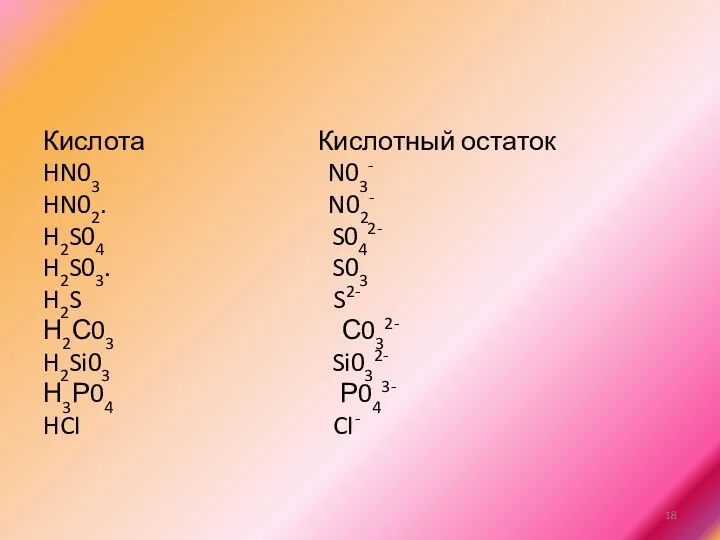
Кислота Кислотный остаток
HN03 N03-
HN02. N02-
H2S04 S042-
H2S03. S03
H2S S2-
Н2С03 С032-
H2Si03 Si032-
Н3Р04
Р043-
HCI CI-
Слайд 19
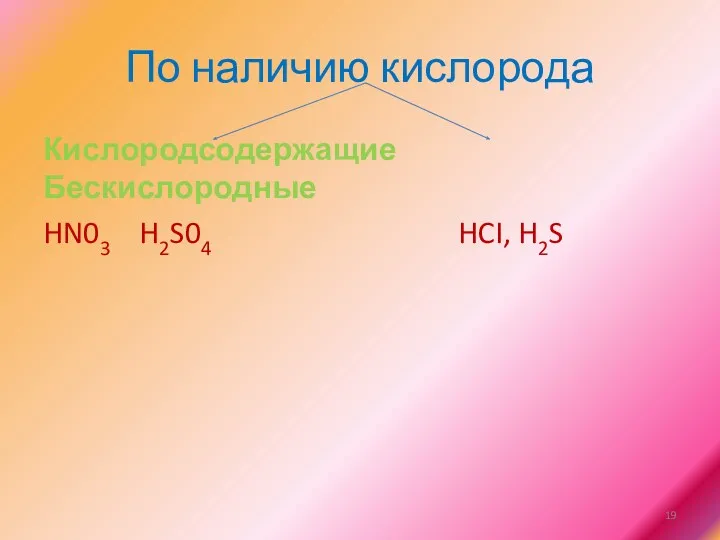
По наличию кислорода
Кислородсодержащие Бескислородные
HN03 H2S04 HCI, H2S
Слайд 20

Станция «Правила техники безопасности»
Правила техники безопасности (инструкция)
При работе с кислотами
необходимо соблюдать некоторые правила техники безопасности:
1. Необходимо наливать в пробирку количество кислоты, которое указано в инструкции.
2. Заполнять пробирку можно только на 1/3 объема.
3. Взбалтывать вещества следует, слегка покачивая пробиркой, при этом не закрывать ее отверстие пальцем.
4. При разбавлении концентрированной серной кислоты выделяется большое количество теплоты. Поэтому смешивать концентрированную кислоту с водой следует с большой осторожностью: надо вливать серную кислоту в воду, а не наоборот. Если вливать воду в серную кислоту, то часть воды за счет выделения теплоты может нагреться до кипения. Кислота начнет разбрызгиваться и может попасть на кожу, в глаза.
5.Концентрированная серная кислота вызывает ожоги. Поэтому попавшую на кожу или ткань кислоту необходимо тотчас стряхнуть, смыть большим количеством воды, а затем раствором питьевой соды и вновь смыть водой.
Слайд 21

Лабораторный опыт
Концентрированная серная кислота обугливает органические вещества.
Правила техники безопасности:
Внимание!
Работать
с кислотами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты на кожу надо смыть ее струей воды.
Слайд 22
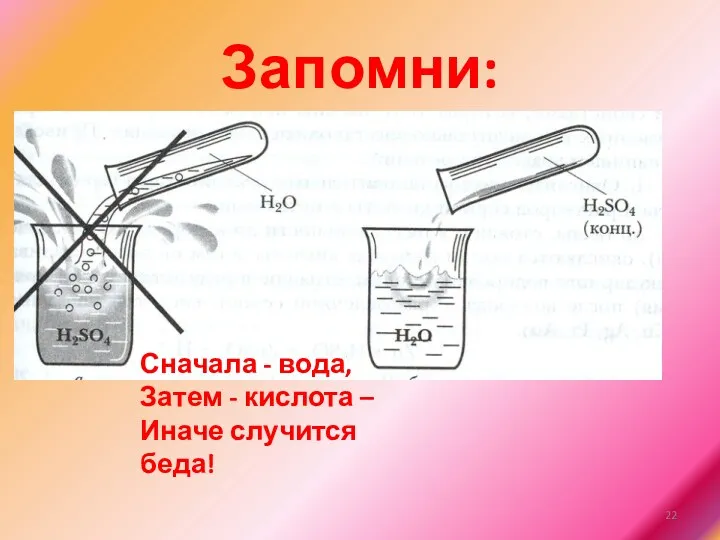
Запомни:
Сначала - вода,
Затем - кислота –
Иначе случится беда!
Слайд 23

Станция «Экспериментальная» Исследовательский эксперимент
Цель: выяснить, в каких пробирках находятся кислоты,
основание, используя индикаторы.
Даны три пронумерованные пробирки в них налиты1кислота (HCI ), основание (NaOH) и Н2О
Определить с помощью индикатора, в какой пробирке кислоты и основание.
Слайд 24

Вывод:
1. Нейтральная среда
2. Кислота
3. Основание
Слайд 25

Станция «Конечная»
Проверочный тест
(самоконтроль)
1. Выберите группу только кислородсодержащих кислот:
А) НСI, Н2SО4, Н2СО3;
Б)
Н NО3, Н3 РО4, Н2SО4;
В) Н2S, Н NО3, НСI.
2.При разбавлении кислоты:
А) воду вливают в кислоту;
Б) кислоту в воду;
В) воду и кислоту вместе смешивают.
3.Под действием кислот лакмус фиолетовый становится:
А) синим;
Б) красным;
В) бесцветным.
4. Выберите группу только двухосновных кислот:
А) Н NО3, Н3 РО4, Н2SО4;
Б) НСI, Н2SО4, Н2СО3;
Б) Н2SО4, Н2СО3; Н2SО3.
5. Выберите группу веществ, в которой указаны только формулы кислот:
А) НNО3, Н3РО4, Н2SО4;
Б) НСI, NaOH, СО2;
В) N2О5, Н3РО4, Н2SО4
Слайд 26

Ответы
1. Б
2. Б
3. Б
4. В
5. А
Слайд 27

Домашнее задание:
§ 20, учить формулы и названия кислот,
подготовиться к химическому
диктанту
Слайд 28

Рефлексия
Если вам понравилось работать на уроке улыбнитесь вместе со мной



























 Тема 3. Товарне виробництво. Товар і гроші. Лекція 2: Вартість товару, еволюція форм вартості
Тема 3. Товарне виробництво. Товар і гроші. Лекція 2: Вартість товару, еволюція форм вартості Презентация Рельеф дна Мирового океана 6 класс
Презентация Рельеф дна Мирового океана 6 класс Память. Как устроена память
Память. Как устроена память Артикуляционная гимнастика для девочек
Артикуляционная гимнастика для девочек Требования Камминз к диагностике, ремонту и оформлению рекламационных актов
Требования Камминз к диагностике, ремонту и оформлению рекламационных актов Использование творческих заданий на уроках музыки как фактор развития индивидуальности личности/
Использование творческих заданий на уроках музыки как фактор развития индивидуальности личности/ Гео-шоу: Покажи мне мою страну
Гео-шоу: Покажи мне мою страну родителям об электронном дневнике и журнале
родителям об электронном дневнике и журнале Внутренняя политика Николая II
Внутренняя политика Николая II Optics. Basic photometric values and their units
Optics. Basic photometric values and their units Кто такие динозавры?
Кто такие динозавры? Презентация Необычные памятники России
Презентация Необычные памятники России Самбо
Самбо особенности одаренных и проблемных детей
особенности одаренных и проблемных детей The Las Vegas Boulevard Tracker Interface
The Las Vegas Boulevard Tracker Interface Задержка психического развития
Задержка психического развития Внедрение технологических процессов изготовления деталей машин и осуществление технологического контроля
Внедрение технологических процессов изготовления деталей машин и осуществление технологического контроля Квадратичная функция
Квадратичная функция Безопасный локомотивный объединенный комплекс (БЛОК). Назначение, устройство, технические характеристики
Безопасный локомотивный объединенный комплекс (БЛОК). Назначение, устройство, технические характеристики Презентация основных тезисов программы Музыкальный калейдоскоп
Презентация основных тезисов программы Музыкальный калейдоскоп 8 МАРТА
8 МАРТА 20231016_zagovor_v_zerentuyskom_rudnike
20231016_zagovor_v_zerentuyskom_rudnike Рак легкого
Рак легкого Робота МЗС на консульському напрямі у 2017 році. Департамент консульської служби, 2018 рік
Робота МЗС на консульському напрямі у 2017 році. Департамент консульської служби, 2018 рік Функции управления
Функции управления Опыт работы кл.рук 2
Опыт работы кл.рук 2 Норма права
Норма права Лазер. Спонтанное (самопроизвольное) излучение
Лазер. Спонтанное (самопроизвольное) излучение