Пути передачи сигнала внутрь клетки: внутриклеточный сигналинг посредством сопряжённых с G-белками и с ферментами рецепторов презентация
Содержание
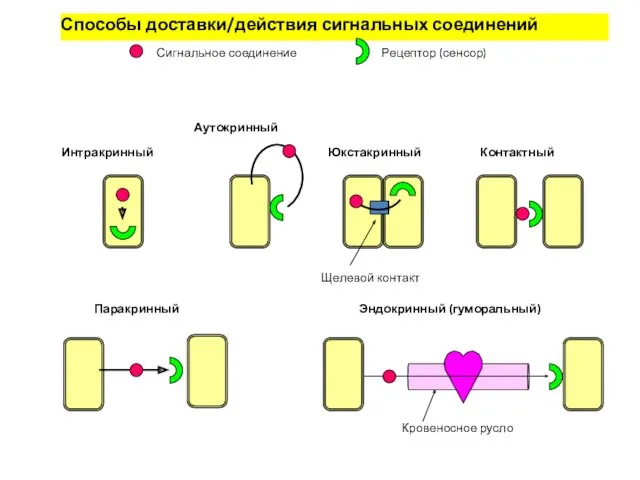
- 2. Основные способы межклеточной сигнализации Контактная сигнализация с помощью молекул, связанных с плазматической мембраной Контактная сигнализация через
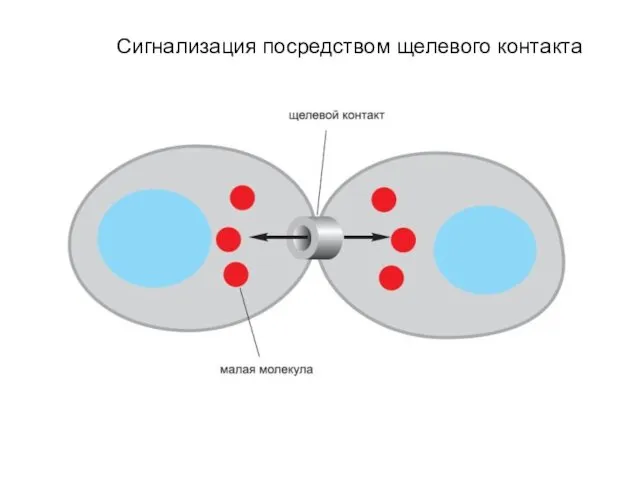
- 4. Сигнализация посредством щелевого контакта
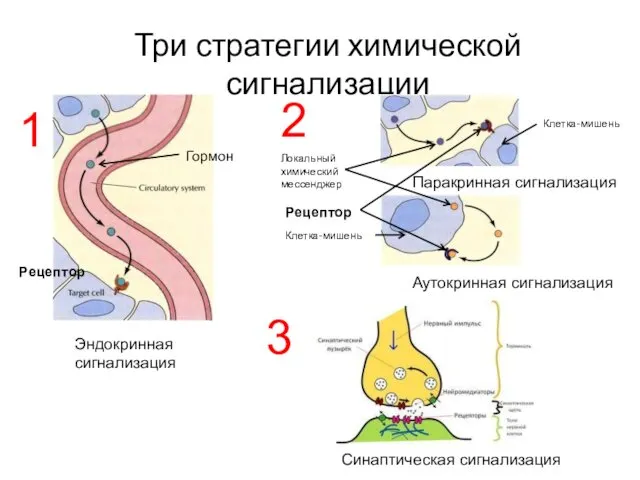
- 5. Три стратегии химической сигнализации
- 6. Особенности эндокринной и нервной сигнализации Эндокринная Медленная (минуты) Низкая вероятность воздействия на мишень (удаленность) Стратегии сигналинга:
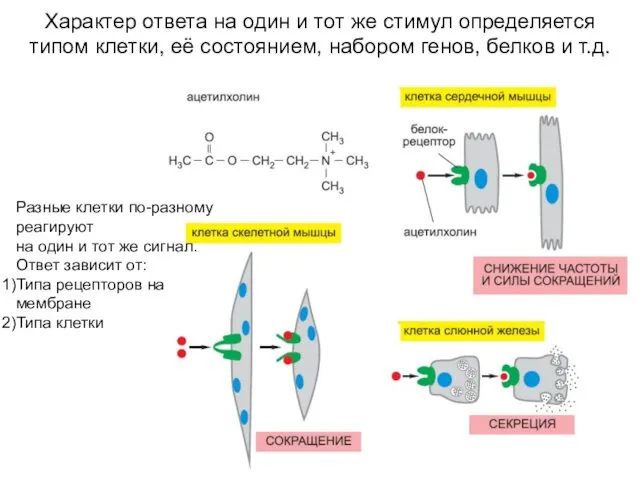
- 7. Характер ответа на один и тот же стимул определяется типом клетки, её состоянием, набором генов, белков
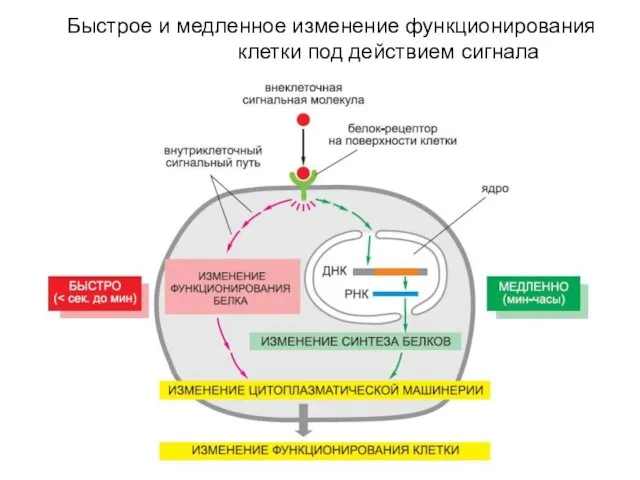
- 8. Быстрое и медленное изменение функционирования клетки под действием сигнала
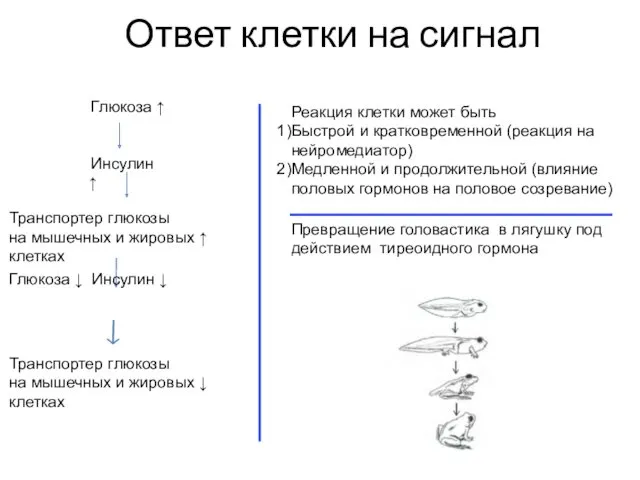
- 9. Ответ клетки на сигнал Глюкоза ↑ Инсулин ↑ Транспортер глюкозы на мышечных и жировых ↑ клетках
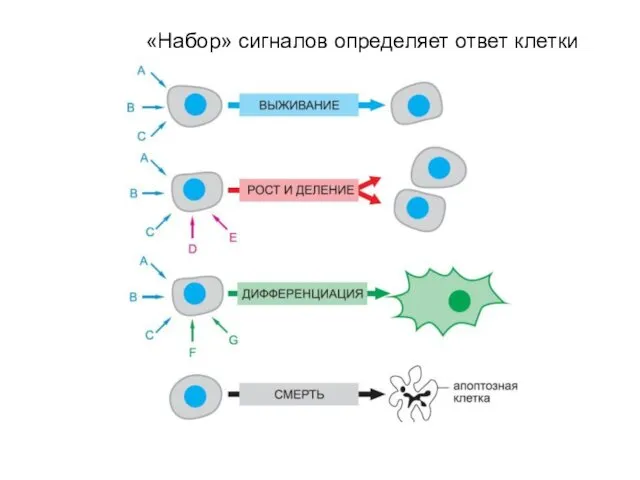
- 10. «Набор» сигналов определяет ответ клетки
- 11. Структура и биосинтез сигнальных соединений
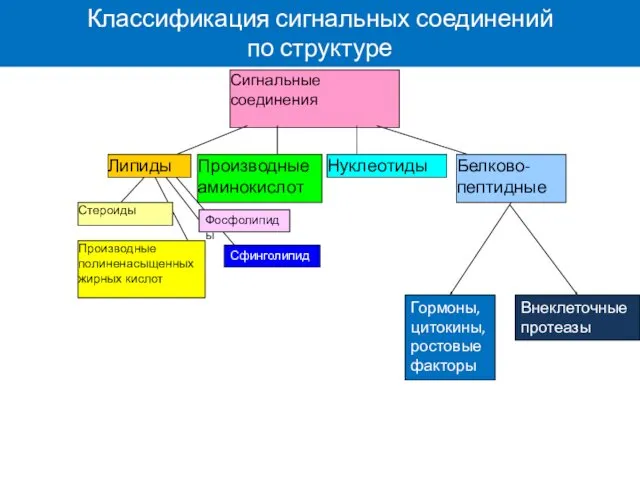
- 12. Липиды Стероиды Производные полиненасыщенных жирных кислот Производные аминокислот Нуклеотиды Белково-пептидные Сигнальные соединения Фосфолипиды Сфинголипиды Классификация сигнальных
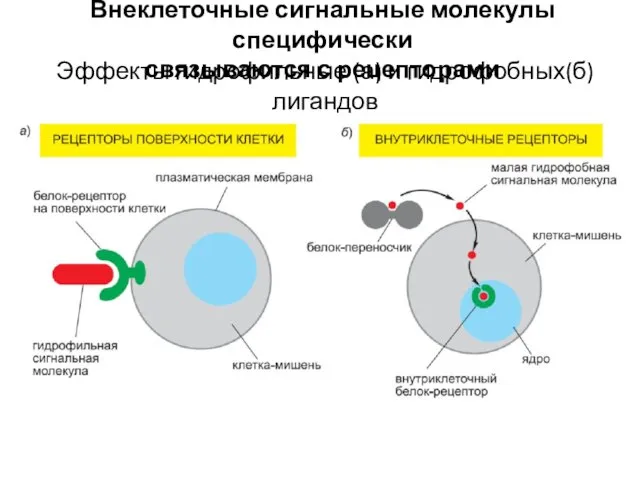
- 14. Внеклеточные сигнальные молекулы специфически связываются с рецепторами Эффекты гидрофильные (а) и гидрофобных(б) лигандов
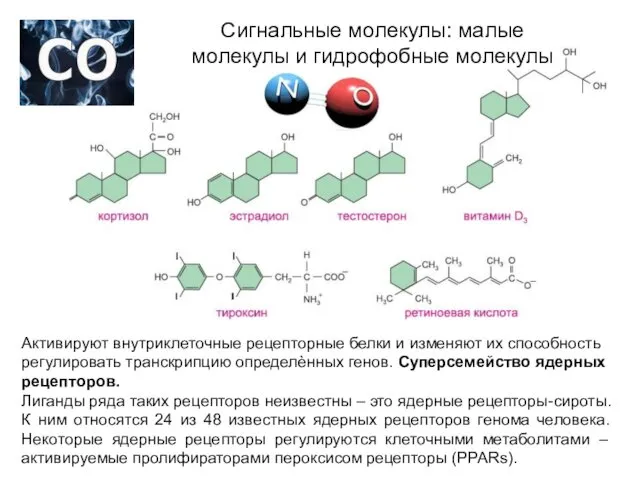
- 15. Сигнальные молекулы: малые молекулы и гидрофобные молекулы Активируют внутриклеточные рецепторные белки и изменяют их способность регулировать
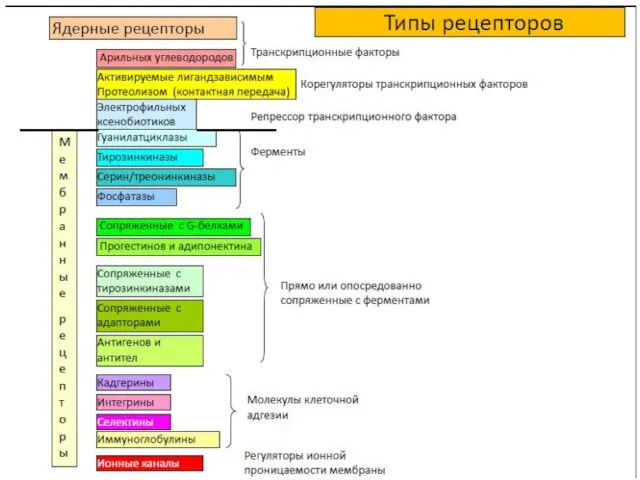
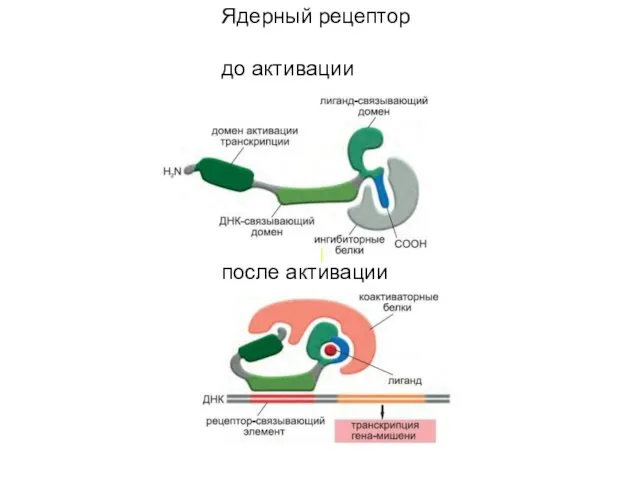
- 16. Ядерные рецепторы — это лиганд-зависимые белки- регуляторы генов
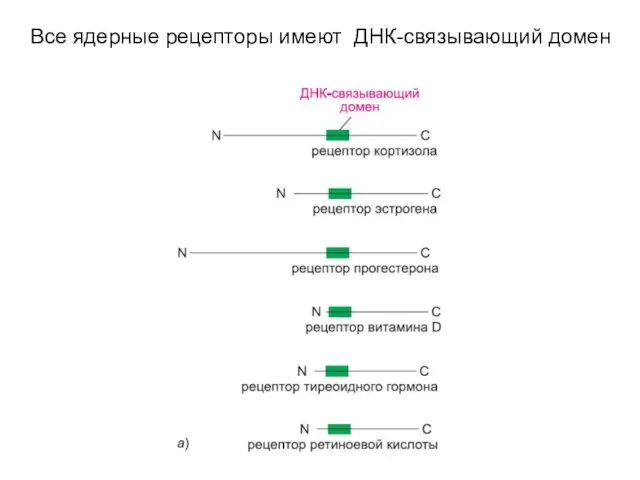
- 17. Все ядерные рецепторы имеют ДНК-связывающий домен
- 18. Ядерный рецептор до активации после активации
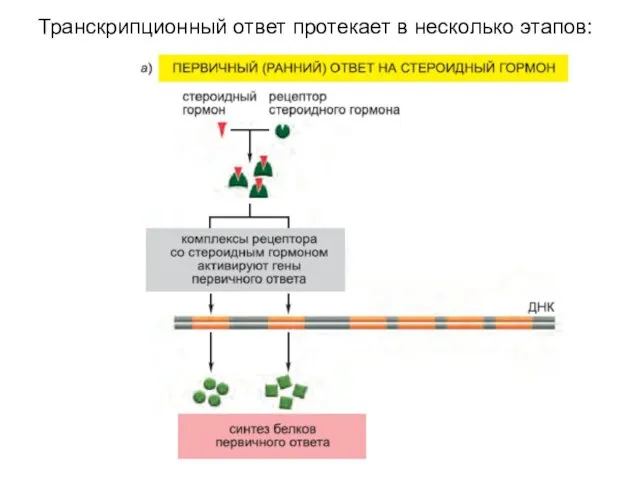
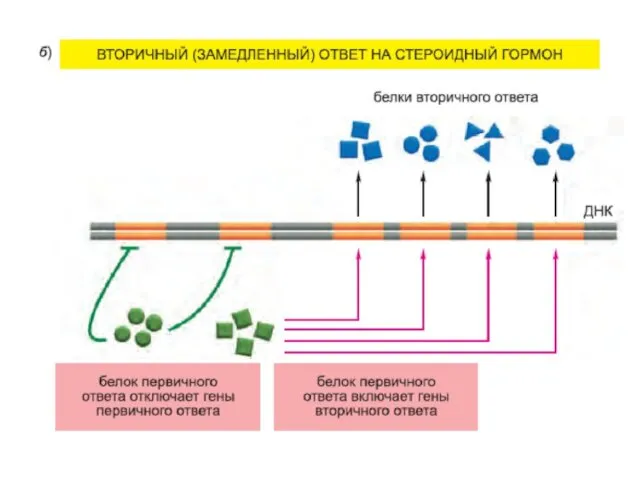
- 19. Транскрипционный ответ протекает в несколько этапов:
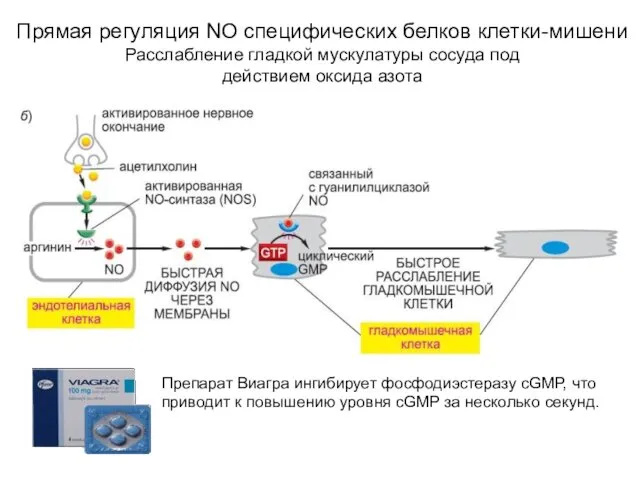
- 21. Прямая регуляция NO специфических белков клетки-мишени Расслабление гладкой мускулатуры сосуда под действием оксида азота Препарат Виагра
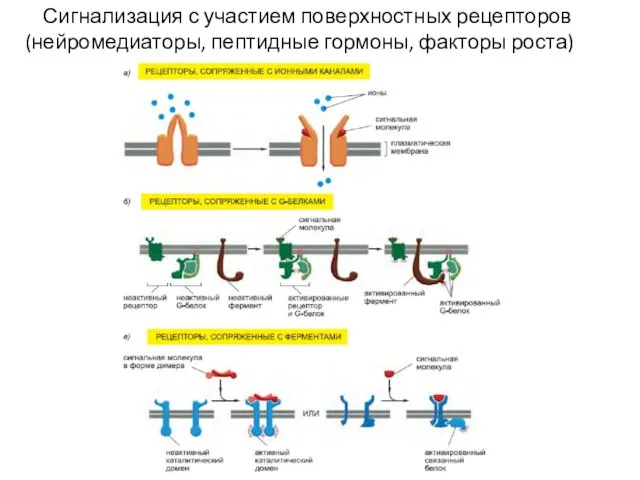
- 22. Сигнализация с участием поверхностных рецепторов (нейромедиаторы, пептидные гормоны, факторы роста)
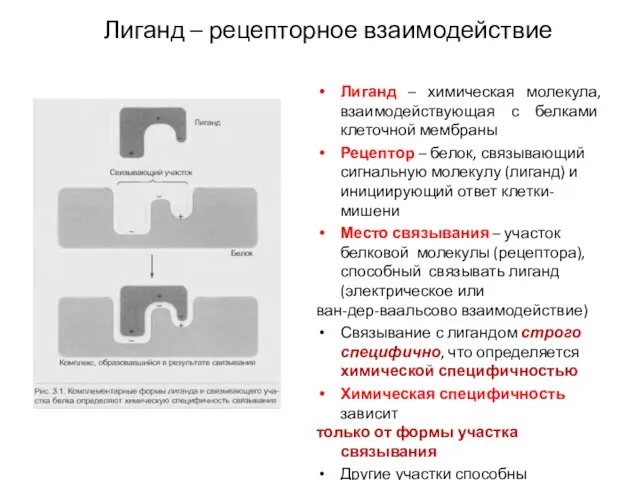
- 23. Лиганд – химическая молекула, взаимодействующая с белками клеточной мембраны Рецептор – белок, связывающий сигнальную молекулу (лиганд)
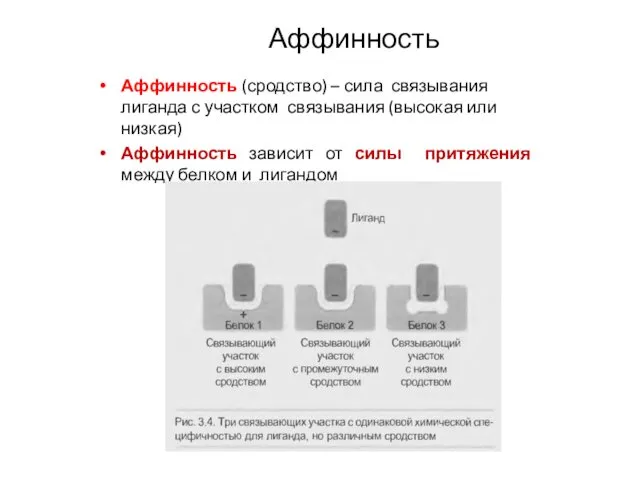
- 24. Аффинность Аффинность (сродство) – сила связывания лиганда с участком связывания (высокая или низкая) Аффинность зависит от
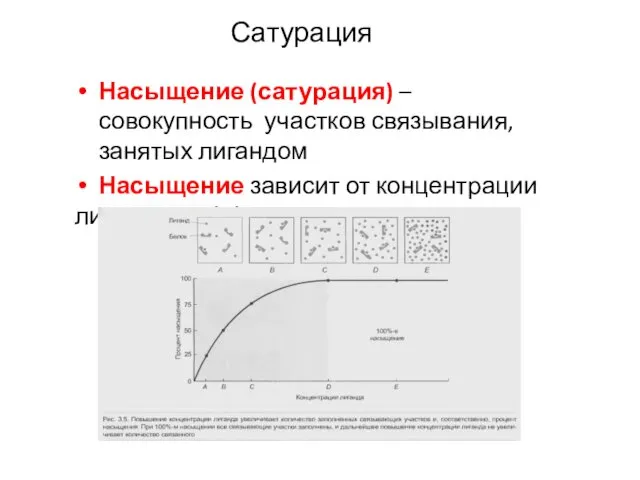
- 25. Насыщение (сатурация) – совокупность участков связывания, занятых лигандом Насыщение зависит от концентрации лиганда и аффинности участка
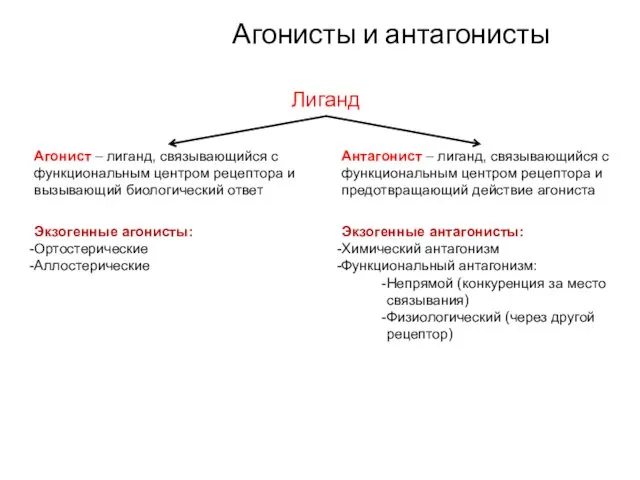
- 26. Агонисты и антагонисты Лиганд Агонист – лиганд, связывающийся с функциональным центром рецептора и вызывающий биологический ответ
- 27. Контроль конформации белка (форма участка связывания) Регуляция синтеза и деградации белков Регуляция связывания (активности белка)
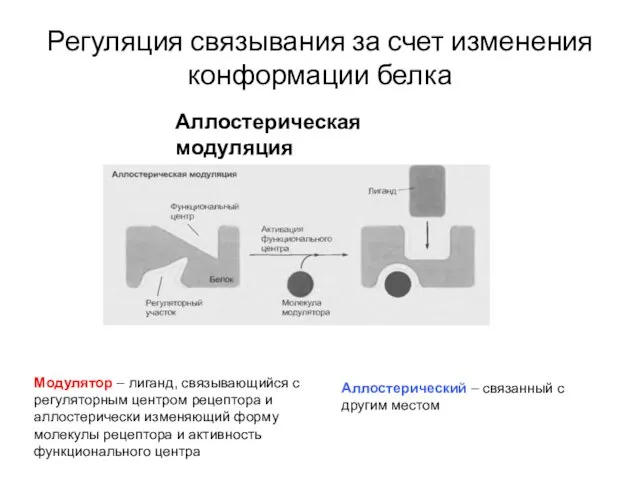
- 28. Регуляция связывания за счет изменения конформации белка Аллостерическая модуляция Модулятор – лиганд, связывающийся с регуляторным центром
- 29. Типы аллостерических модуляторов Аллостерические усилители (enhancers) – модуляторы, усиливающие аффинность ортостерических лигандов и/или эффективность агониста без
- 30. Типы лиганд-лигандных взаимодействий Синтопическое взаимодействие – взаимодействие между лигандами, которые связываются с одним и тем же
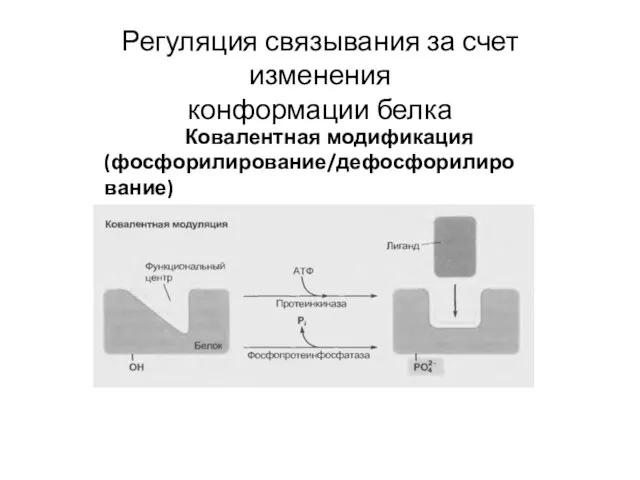
- 31. Регуляция связывания за счет изменения конформации белка Ковалентная модификация (фосфорилирование/дефосфорилирование)
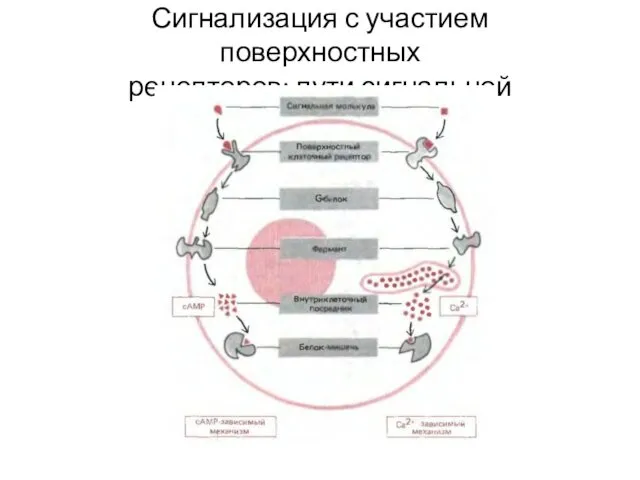
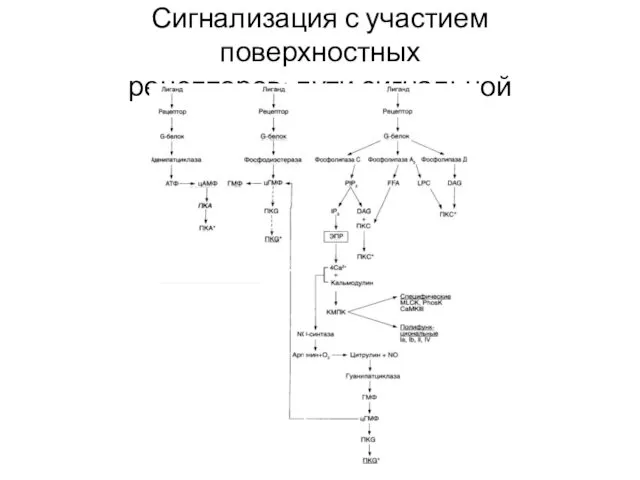
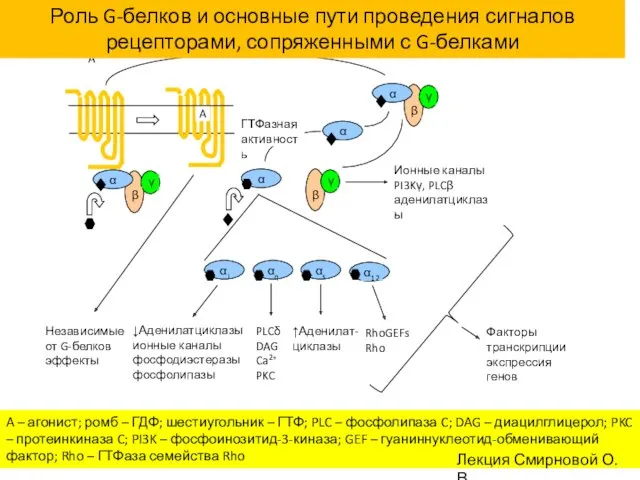
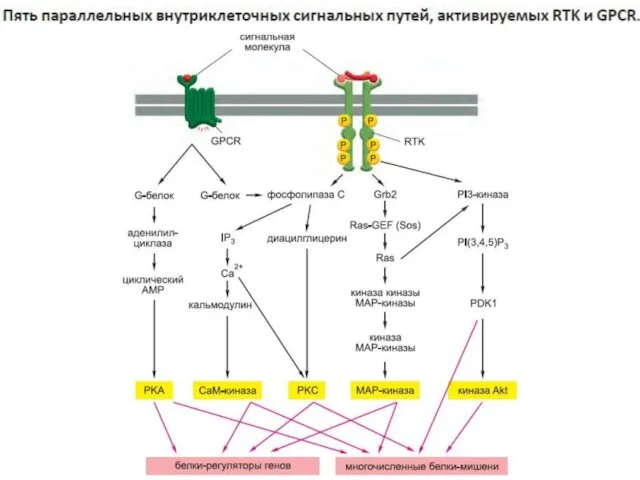
- 32. Сигнализация с участием поверхностных рецепторов: пути сигнальной трансдукции
- 33. Сигнализация с участием поверхностных рецепторов: ГТФ (GTP)-связывающие белки (G- белки) Гетеротримерные G-белки – посредники между мембранными
- 34. Сигнализация с участием поверхностных рецепторов: пути сигнальной трансдукции
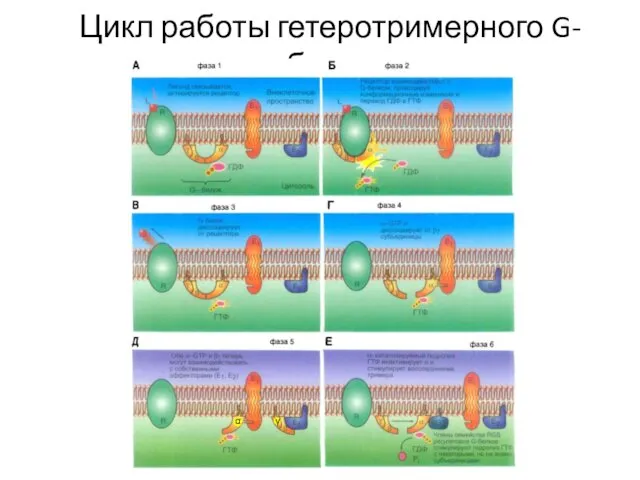
- 35. Цикл работы гетеротримерного G-белка γ α
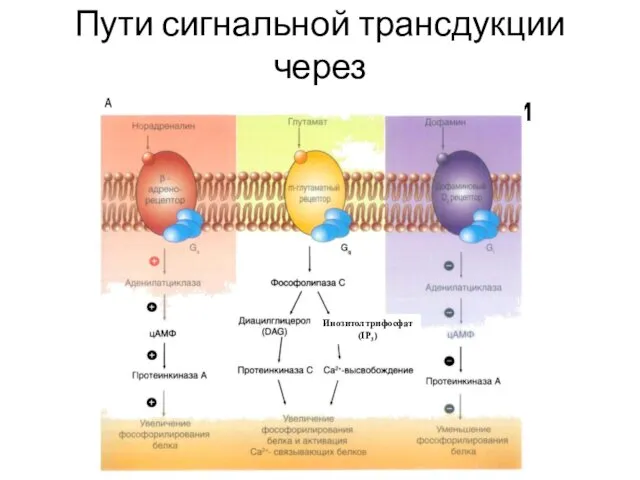
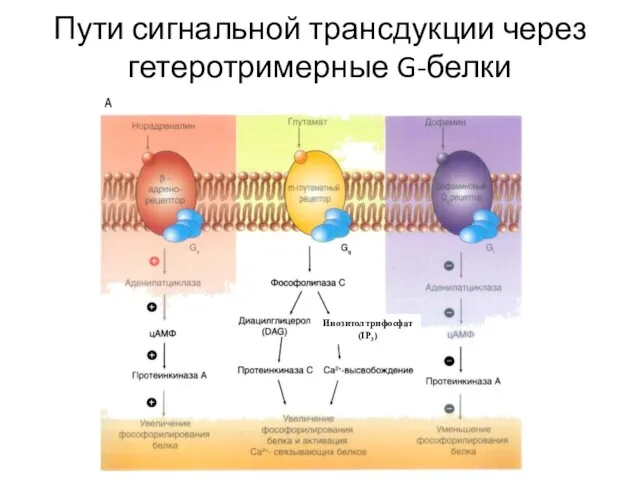
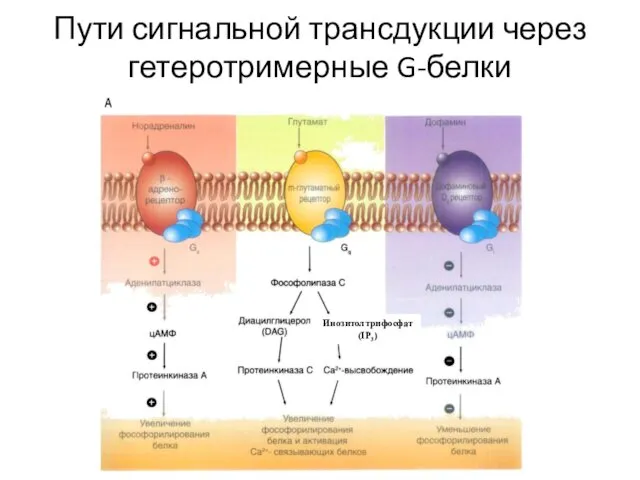
- 36. Пути сигнальной трансдукции через гетеротримерные G-белки Инозитолтрифосфат (IP3)
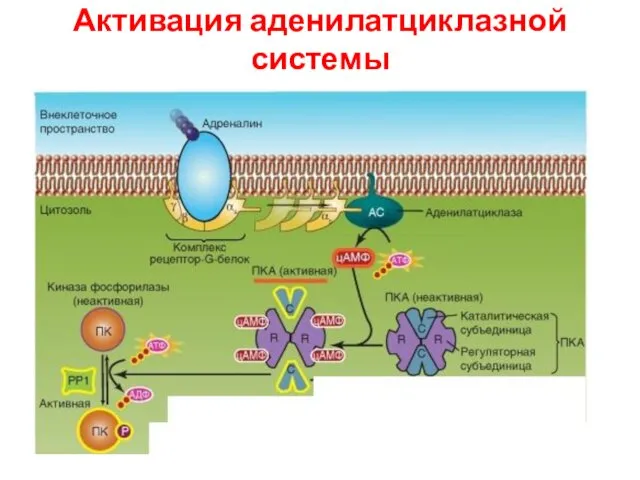
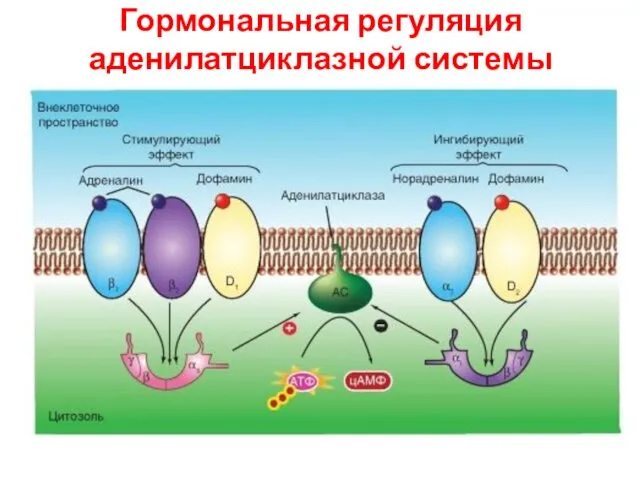
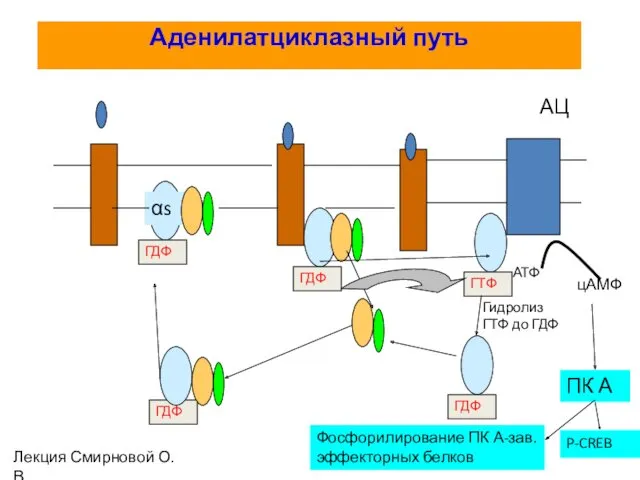
- 37. Активация аденилатциклазной системы
- 38. Гормональная регуляция аденилатциклазной системы
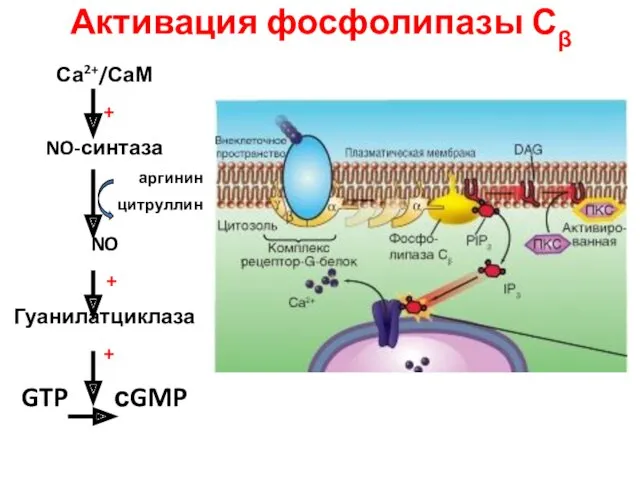
- 39. Активация фосфолипазы Сβ Са2+/СаМ + NO-синтаза аргинин цитруллин NO + Гуанилатциклаза + GTP сGMP
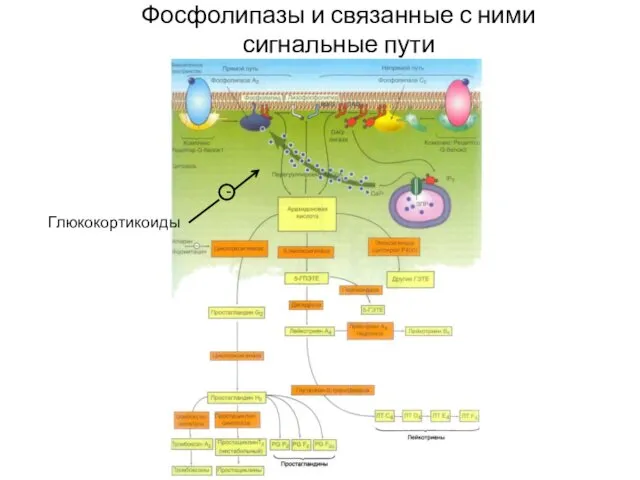
- 40. Фосфолипазы и связанные с ними сигнальные пути - Глюкокортикоиды
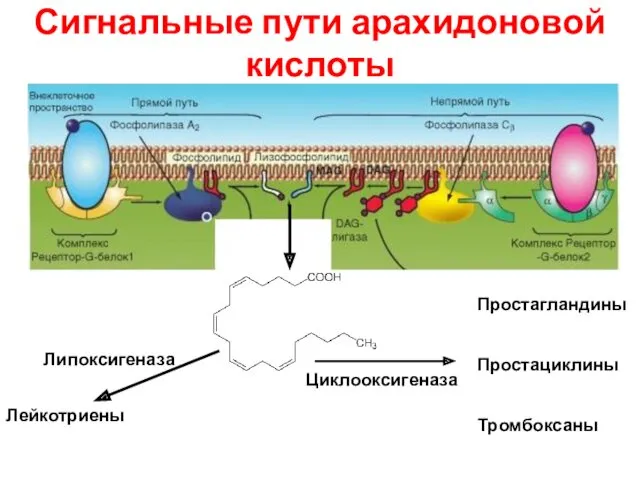
- 41. Сигнальные пути арахидоновой кислоты Циклооксигеназа Липоксигеназа Простагландины Простациклины Тромбоксаны Лейкотриены
- 42. Мономерные малые G-белки
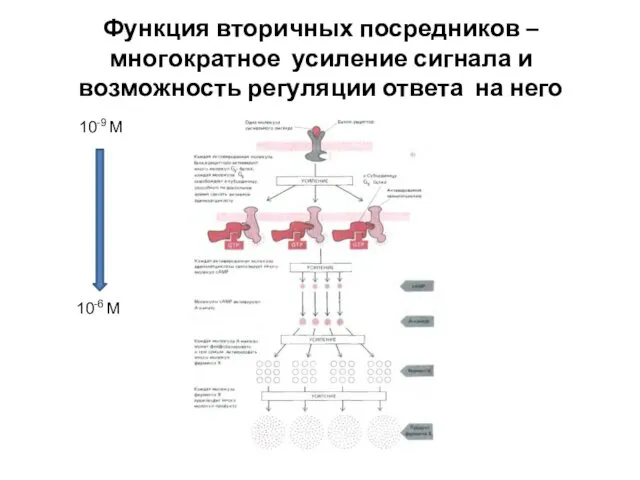
- 43. Функция вторичных посредников – многократное усиление сигнала и возможность регуляции ответа на него 10-9 М 10-6
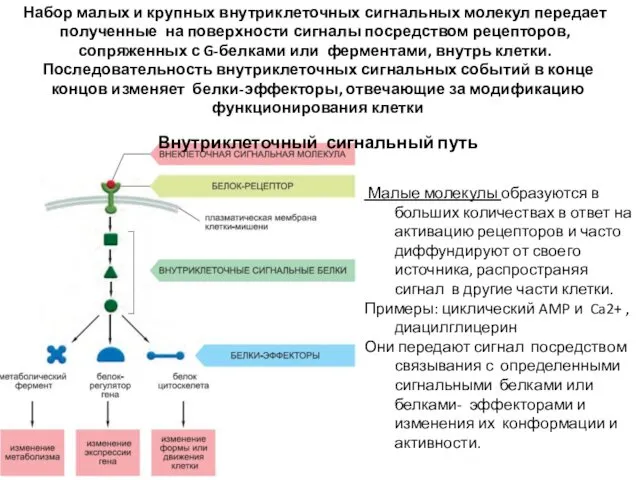
- 44. Набор малых и крупных внутриклеточных сигнальных молекул передает полученные на поверхности сигналы посредством рецепторов, сопряженных с
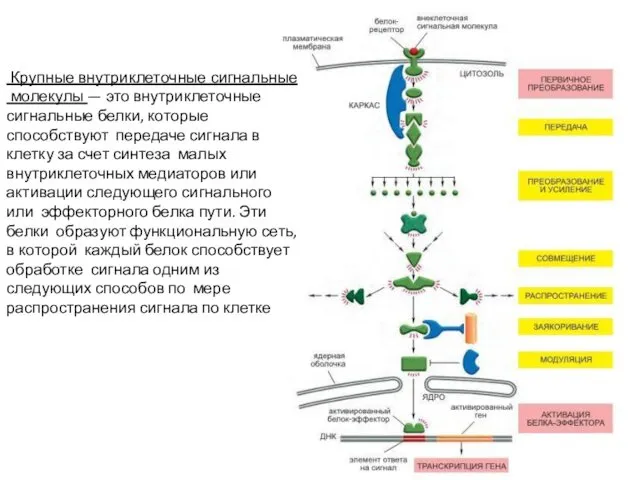
- 45. Крупные внутриклеточные сигнальные молекулы — это внутриклеточные сигнальные белки, которые способствуют передаче сигнала в клетку за
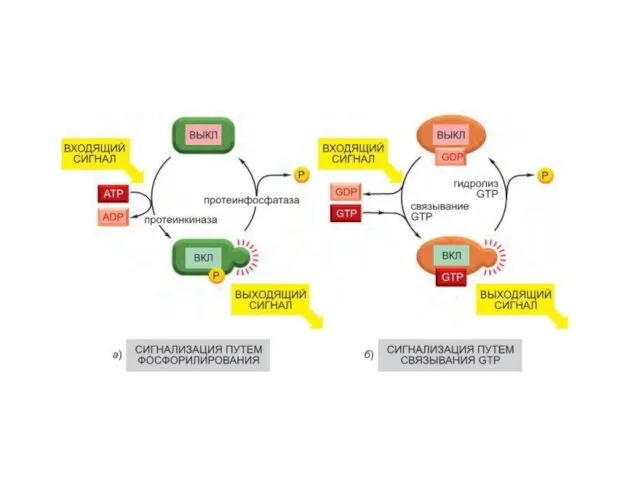
- 46. Многие внутриклеточные сигнальные белки играют роль молекулярных переключателей. Два важных класса молекулярных переключателей белков, активируемых или
- 48. Второй важный класс молекулярных переключателей GTP- связывающие белки (переключаются из активного состояния со связанным GTP в
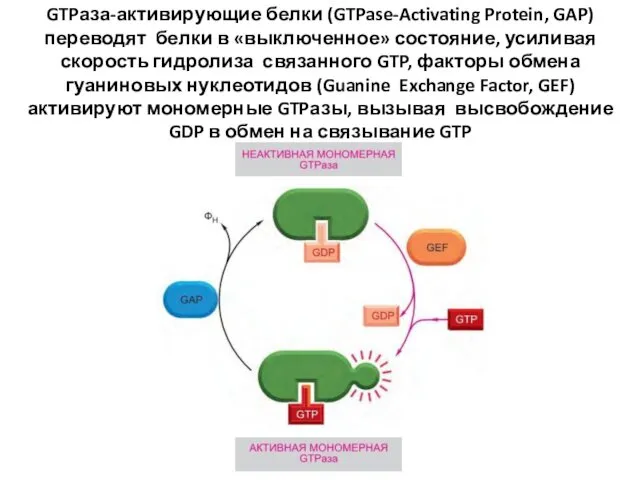
- 49. GTPаза-активирующие белки (GTPase-Activating Protein, GAP) переводят белки в «выключенное» состояние, усиливая скорость гидролиза связанного GTP, факторы
- 50. Внутриклеточные сигнальные комплексы увеличивают скорость, эффективность и специфичность ответа Как же тогда клетка способна специфически отвечать
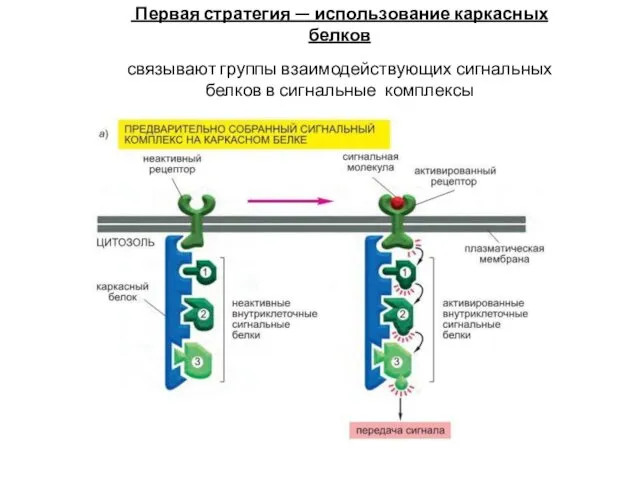
- 51. Первая стратегия — использование каркасных белков связывают группы взаимодействующих сигнальных белков в сигнальные комплексы
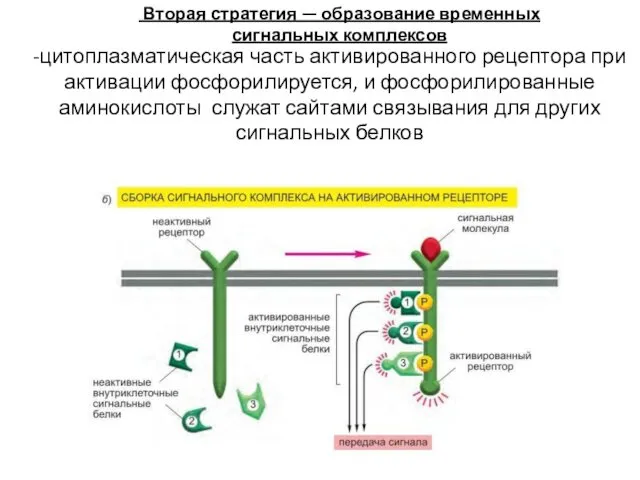
- 52. -цитоплазматическая часть активированного рецептора при активации фосфорилируется, и фосфорилированные аминокислоты служат сайтами связывания для других сигнальных
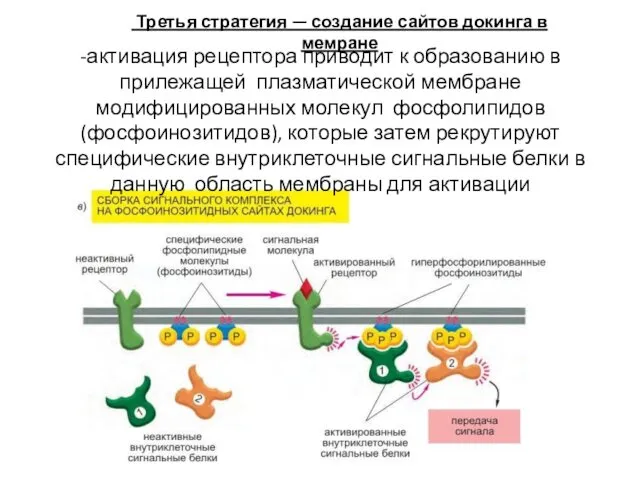
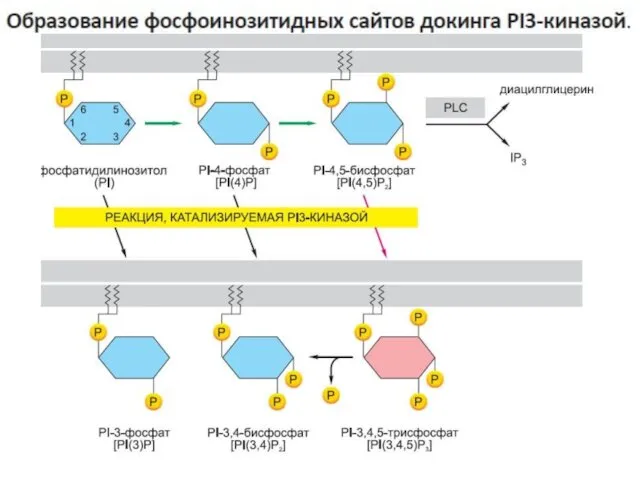
- 53. -активация рецептора приводит к образованию в прилежащей плазматической мембране модифицированных молекул фосфолипидов (фосфоинозитидов), которые затем рекрутируют
- 54. Модульные домены опосредуют взаимодействия между внутриклеточными сигнальными белками Сборка сигнального комплекса зависит от различных небольших высококонсервативных
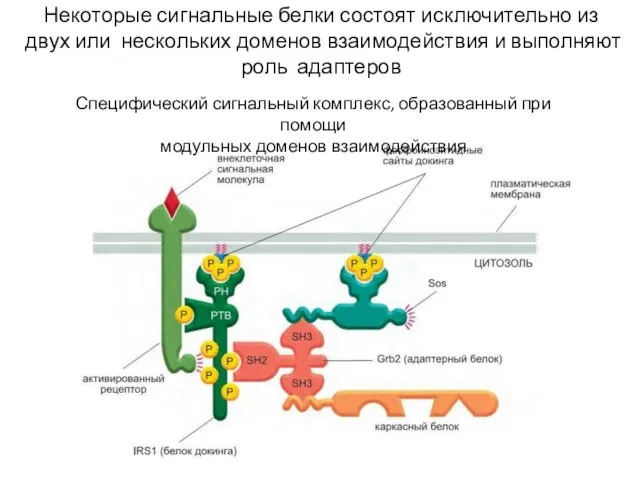
- 55. Некоторые сигнальные белки состоят исключительно из двух или нескольких доменов взаимодействия и выполняют роль адаптеров Специфический
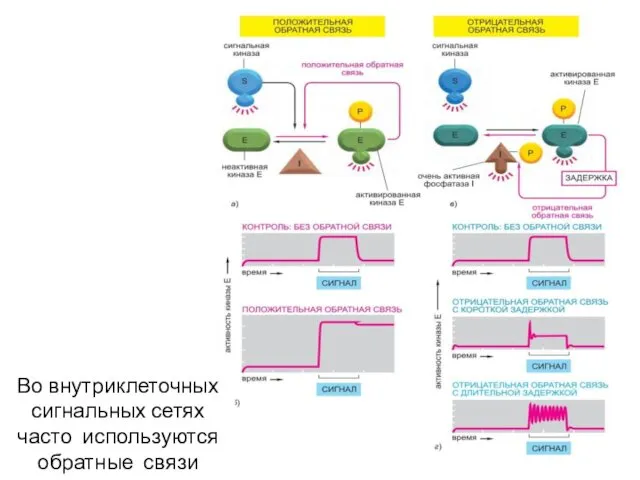
- 56. Во внутриклеточных сигнальных сетях часто используются обратные связи
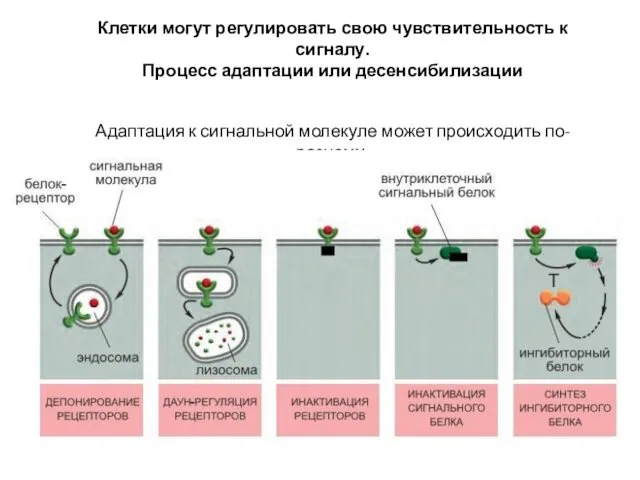
- 57. Клетки могут регулировать свою чувствительность к сигналу. Процесс адаптации или десенсибилизации Адаптация к сигнальной молекуле может
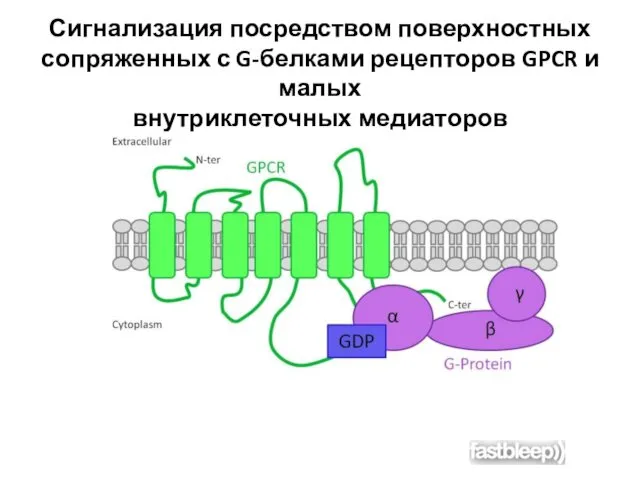
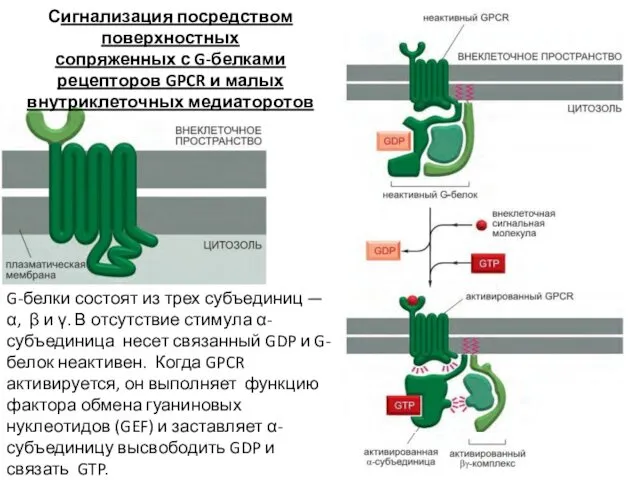
- 58. Сигнализация посредством поверхностных сопряженных с G-белками рецепторов GPCR и малых внутриклеточных медиаторов
- 59. G-белки состоят из трех субъединиц — α, β и γ. В отсутствие стимула α-субъединица несет связанный
- 60. A – агонист; ромб – ГДФ; шестиугольник – ГТФ; PLC – фосфолипаза C; DAG – диацилглицерол;
- 61. GTPазная активность усиливается связыванием α-субъединицы со вторым белком – белком-мишенью или специфическим регулятором сигнальных путей G-белков
- 62. Аденилатциклазный путь αs ГДФ ГДФ ГТФ АЦ АТФ цАМФ ГДФ ГДФ ПК А Фосфорилирование ПК А-зав.
- 63. Некоторые G-белки регулируют образование циклического AMP Концентрация cAMP в цитозоле составляет 10-7 М, но внеклеточный сигнал
- 64. У млекопитающих встречается по крайней мере восемь изоформ фермента аденилатциклазы, большая часть которых регулируется одновременно G-белками
- 65. Пути сигнальной трансдукции через гетеротримерные G-белки Инозитолтрифосфат (IP3)
- 66. Некоторые клеточные ответы на гормоны, опосредуемые циклическим AMP Ткань-мишень Гормон Основной ответ
- 67. Действие циклического AMP в основном опосредуется циклический AMP-зависимой протеинкиназой (PKA) Протеинкиназа A фосфорилирует определенные серины или
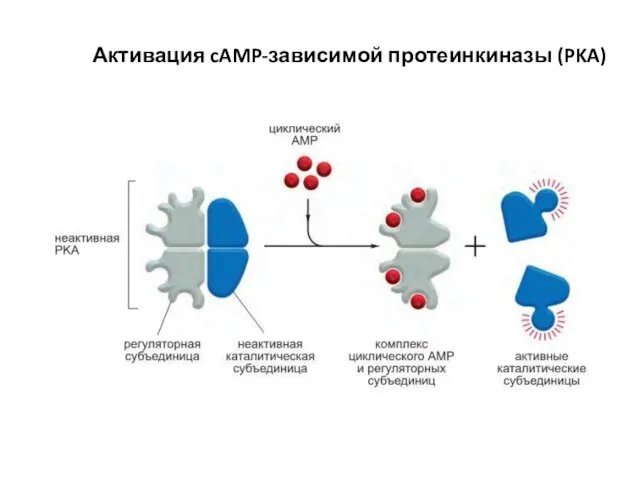
- 68. Активация cAMP-зависимой протеинкиназы (PKA)
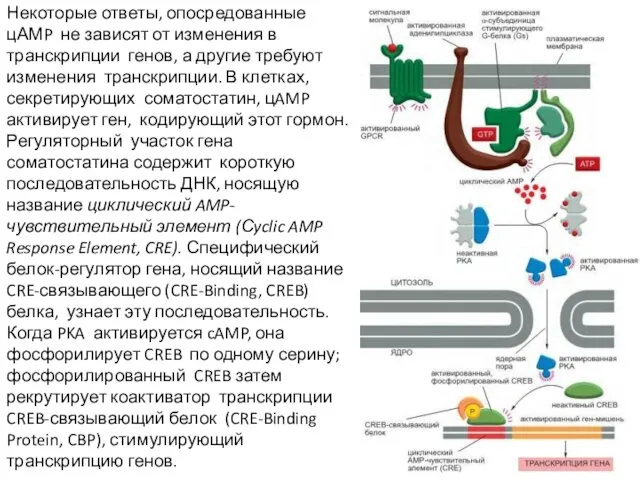
- 69. Некоторые ответы, опосредованные цАМP не зависят от изменения в транскрипции генов, а другие требуют изменения транскрипции.
- 70. Пути сигнальной трансдукции через гетеротримерные G-белки Инозитолтрифосфат (IP3)
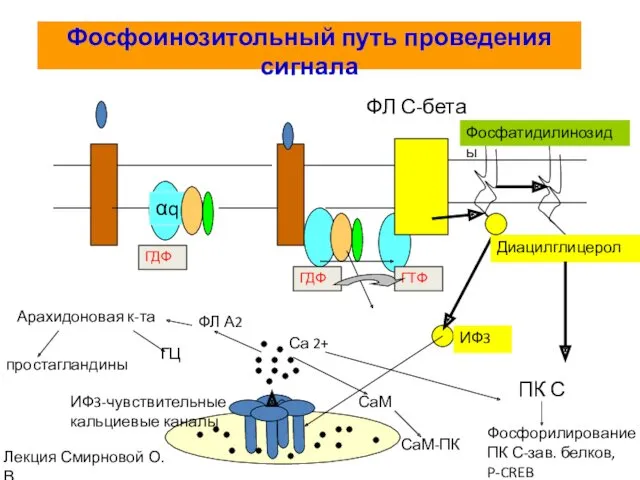
- 71. Фосфоинозитольный путь проведения сигнала αq ГДФ ГДФ ГТФ ФЛ С-бета ИФ3-чувствительные кальциевые каналы Са 2+ ПК
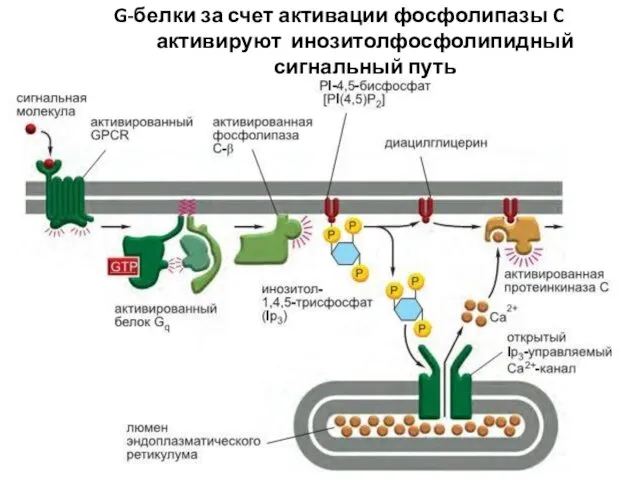
- 72. G-белки за счет активации фосфолипазы C активируют инозитолфосфолипидный сигнальный путь
- 73. Некоторые ответы клеток, при которых GPCR активирует PLCβ Ткань-мишень Сигнальная молекула Основной ответ
- 74. Связанный с плазматической мембраной фермент фосфолипаза C-β (Phospholipase C-β, PLCβ) воздействует на фосфорилированный инозитолфосфолипид (фосфоинозитид) -
- 75. Диацилглицерин остается в плазматической мембране, где может быть расщеплен с высвобождением арахидоновой кислоты - сигнальной молекулы,
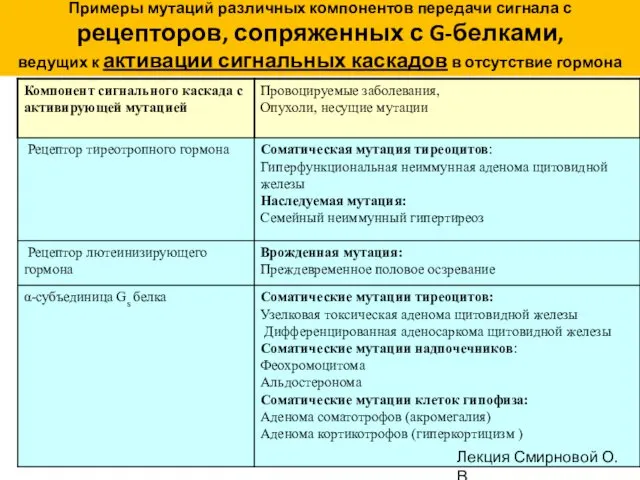
- 76. Примеры мутаций различных компонентов передачи сигнала с рецепторов, сопряженных с G-белками, ведущих к активации сигнальных каскадов
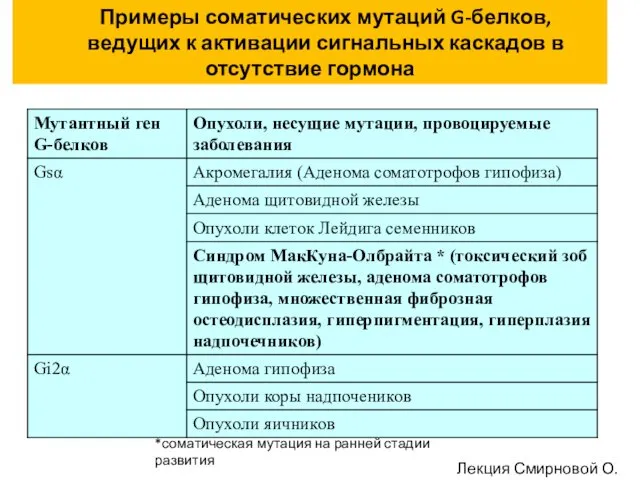
- 77. Примеры соматических мутаций G-белков, ведущих к активации сигнальных каскадов в отсутствие гормона *соматическая мутация на ранней
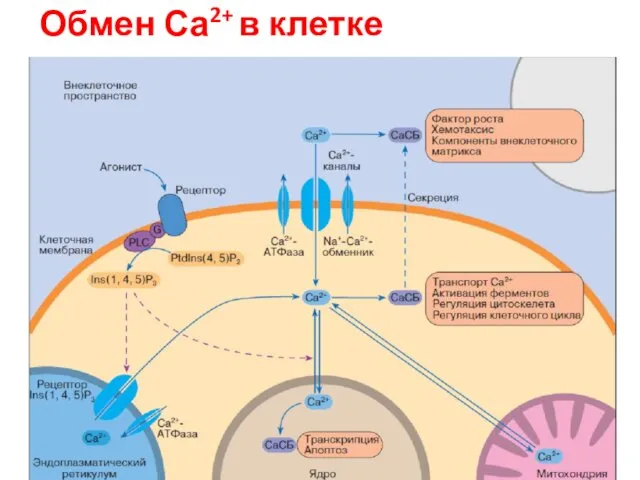
- 78. Ca 2+ функционирует как универсальный внутриклеточный медиатор Сигнал, открывающий Ca2+-каналы мембран ЭР, увеличивает локальную концентрацию иона
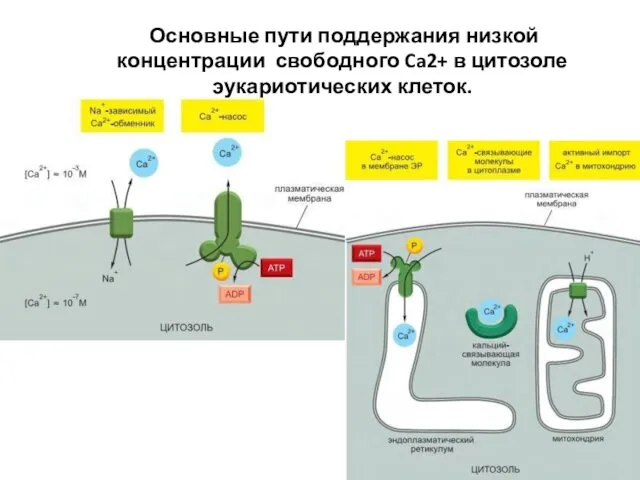
- 79. Основные пути поддержания низкой концентрации свободного Ca2+ в цитозоле эукариотических клеток.
- 80. Обмен Са2+ в клетке
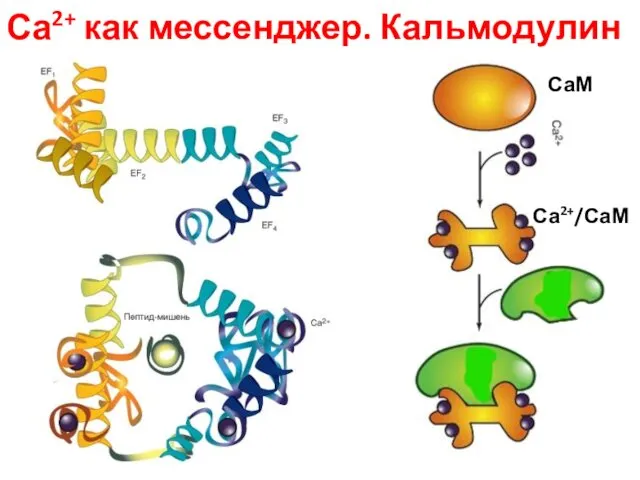
- 81. Са2+ как мессенджер. Кальмодулин СаМ Са2+/СаМ
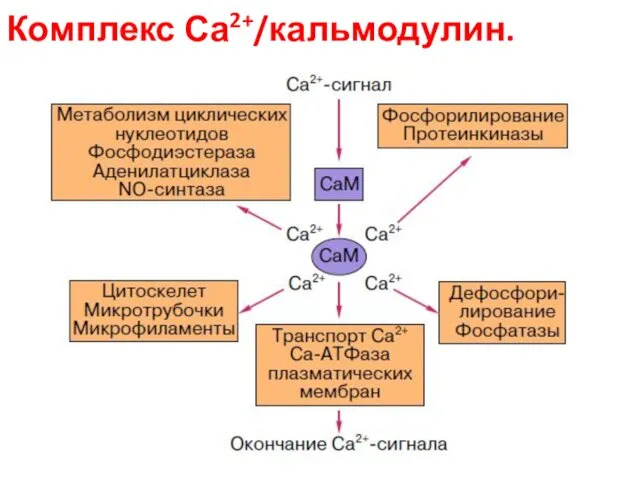
- 82. Комплекс Са2+/кальмодулин.
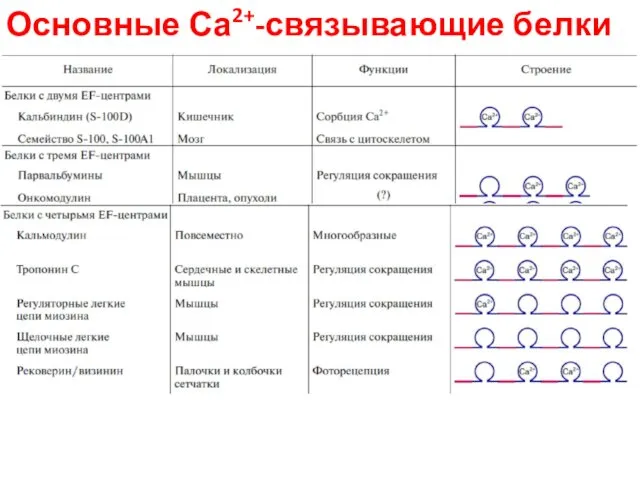
- 83. Основные Са2+-связывающие белки
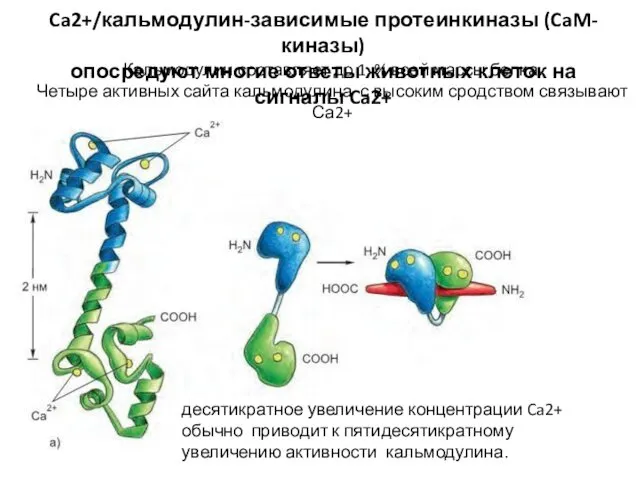
- 84. Ca2+/кальмодулин-зависимые протеинкиназы (CaM-киназы) опосредуют многие ответы животных клеток на сигналы Ca2+ Кальмодулин составляет до 1 %
- 85. Механизмы действия кальмодулина: сам по себе он не обладает ферментативной активностью, действует за счет связывания и
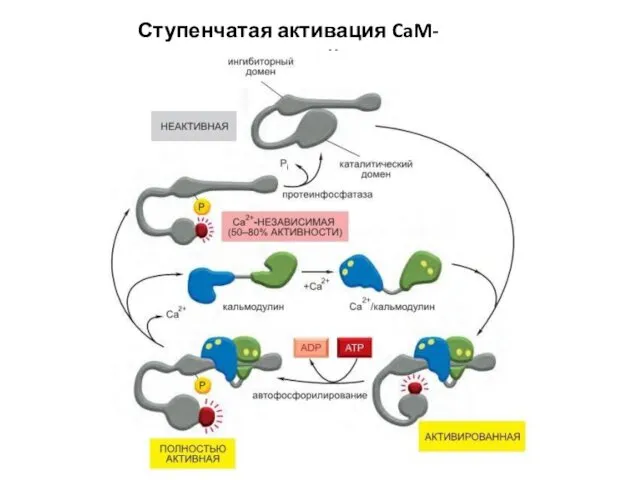
- 86. Ступенчатая активация CaM-киназы II.
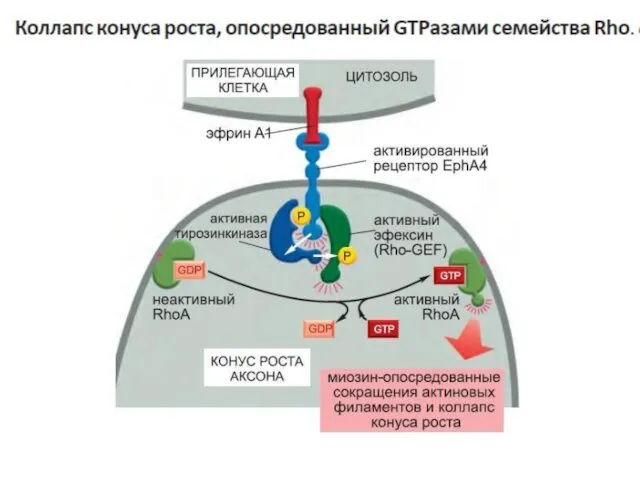
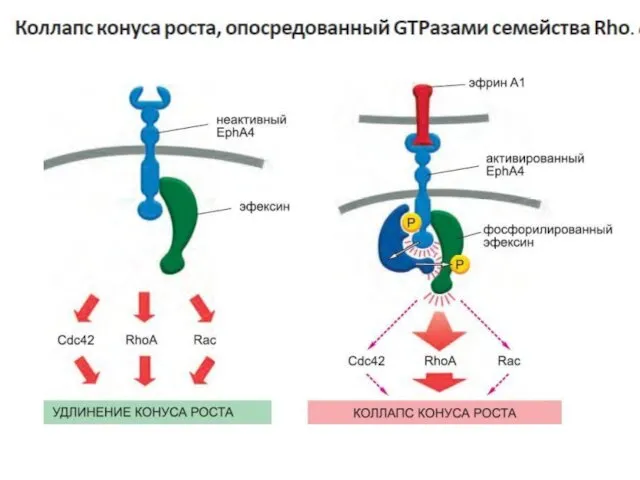
- 87. Некоторые G-белки напрямую регулируют ионные каналы один из типов G-белков- G12 активирует фактор обмена гуаниновых нуклеотидов
- 88. Четыре основных семейства тримерных G-белков Семейство Представители семейства Субъединицы, опосредующие активность Некоторые функции
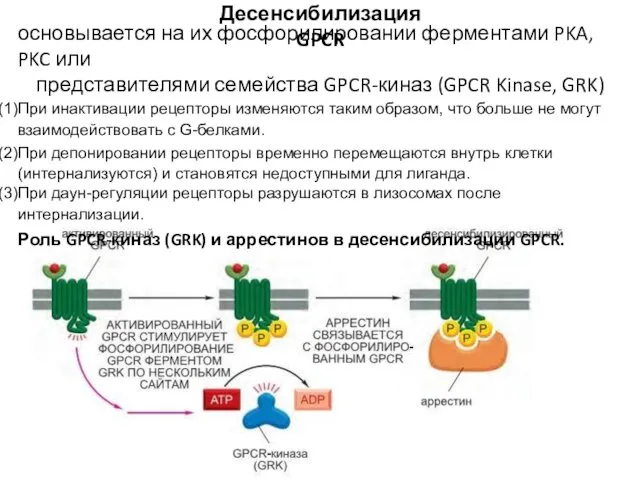
- 89. Десенсибилизация GPCR основывается на их фосфорилировании ферментами PKA, PKC или представителями семейства GPCR-киназ (GPCR Kinase, GRK)
- 90. Основные классы сопряженных с ферментами рецепторов Тирозинкиназные рецепторы напрямую фосфорилируют определенные тирозины на самих себе и
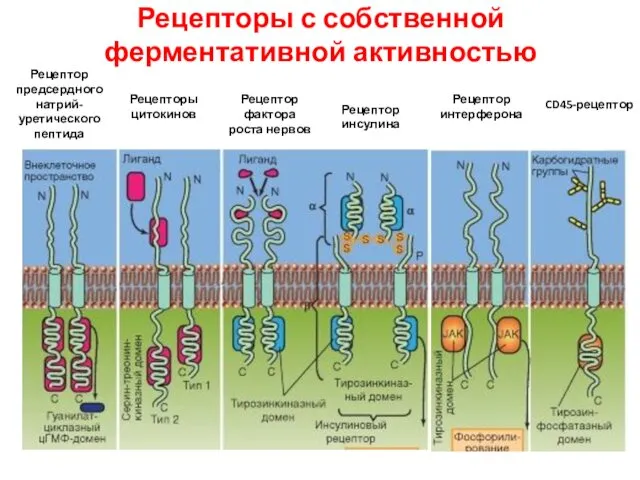
- 91. Рецепторы с собственной ферментативной активностью Рецептор предсердного натрий-уретического пептида Рецепторы цитокинов Рецептор фактора роста нервов Рецептор
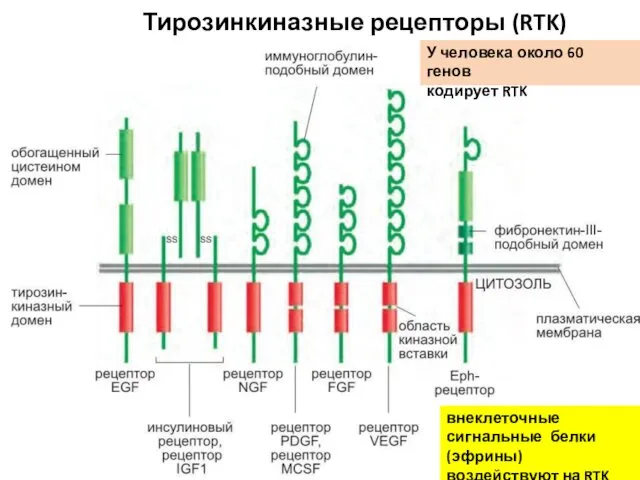
- 92. Тирозинкиназные рецепторы (RTK) внеклеточные сигнальные белки (эфрины) воздействуют на RTK У человека около 60 генов кодирует
- 93. Некоторые сигнальные белки, действующие посредством RTK Сигнальный белок Рецепторы Некоторые ответы
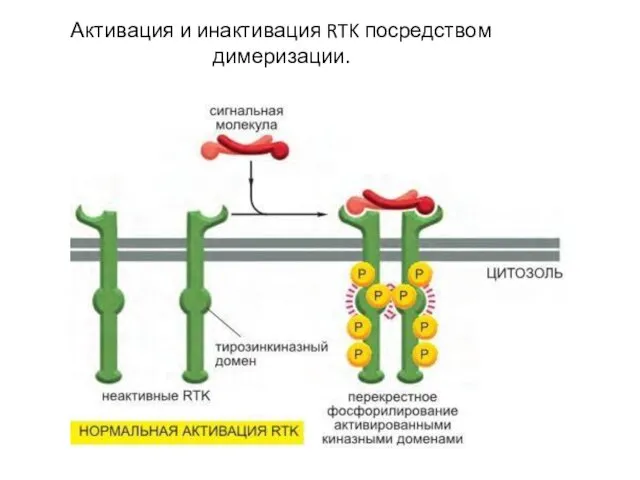
- 94. Этапы активации RTK Активация киназного домена Фосфорилирование тирозиновых остатков в цитоплазматическом домене (путём димеризации (олигомеризации) –перекрёстное
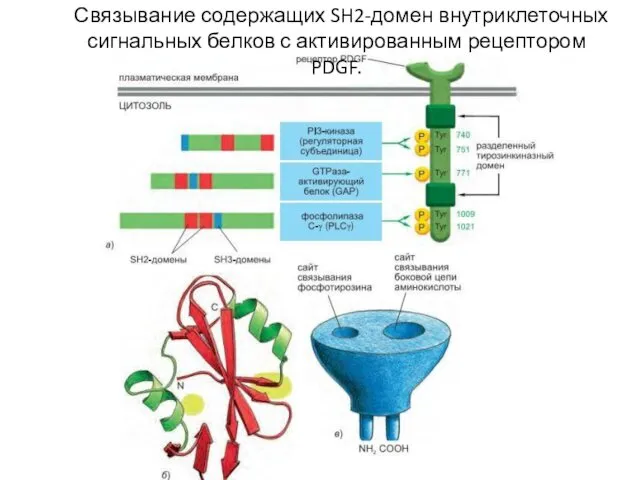
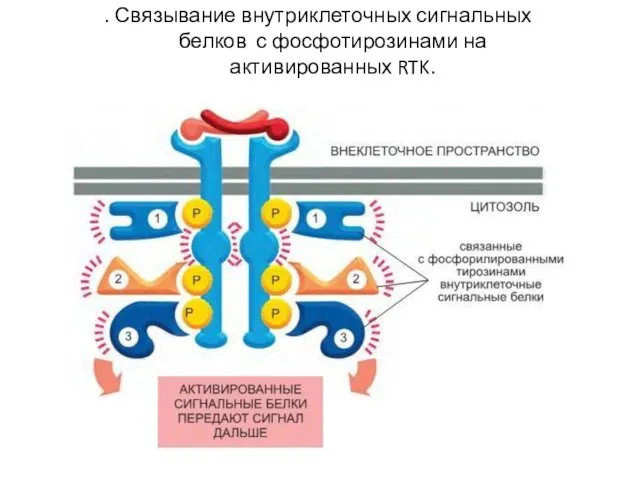
- 95. Связывание содержащих SH2-домен внутриклеточных сигнальных белков с активированным рецептором PDGF.
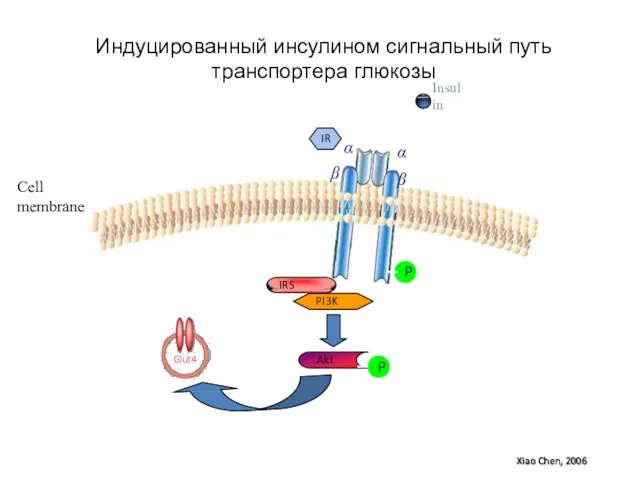
- 96. Insulin P IRS PI3K Akt P IR α β α β Glut4 Индуцированный инсулином сигнальный путь
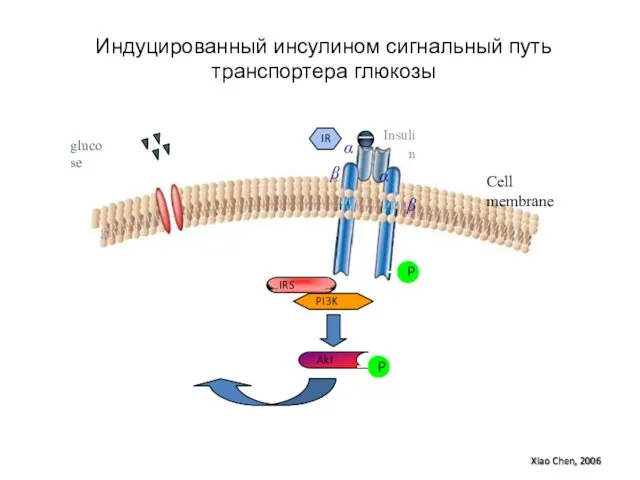
- 97. P IRS PI3K Akt P IR α β Insulin α β glucose Cell membrane Xiao Chen,
- 98. Активация и инактивация RTK посредством димеризации.
- 99. . Связывание внутриклеточных сигнальных белков с фосфотирозинами на активированных RTK.
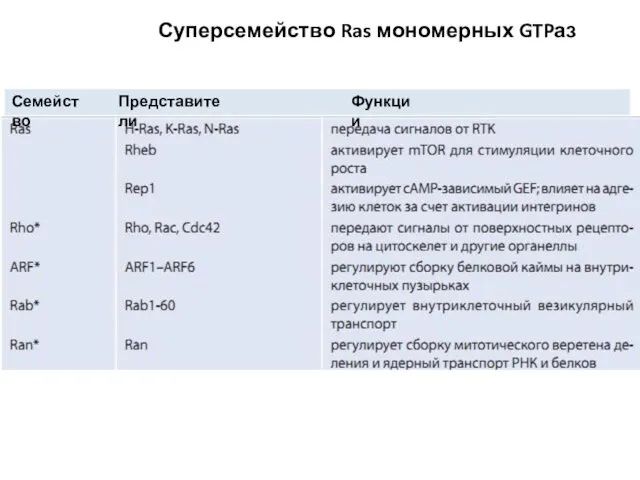
- 100. Суперсемейство Ras мономерных GTPаз Семейство Представители Функции
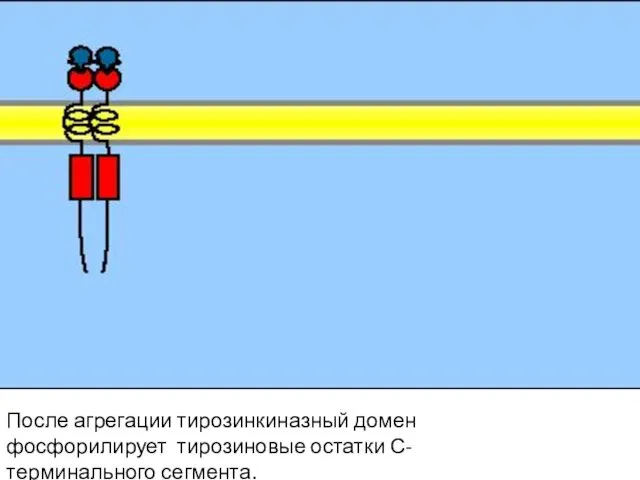
- 103. После агрегации тирозинкиназный домен фосфорилирует тирозиновые остатки С-терминального сегмента.
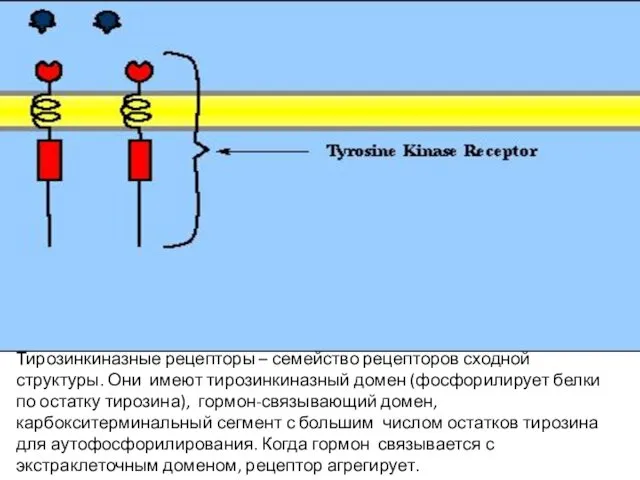
- 104. Тирозинкиназные рецепторы – семейство рецепторов сходной структуры. Они имеют тирозинкиназный домен (фосфорилирует белки по остатку тирозина),
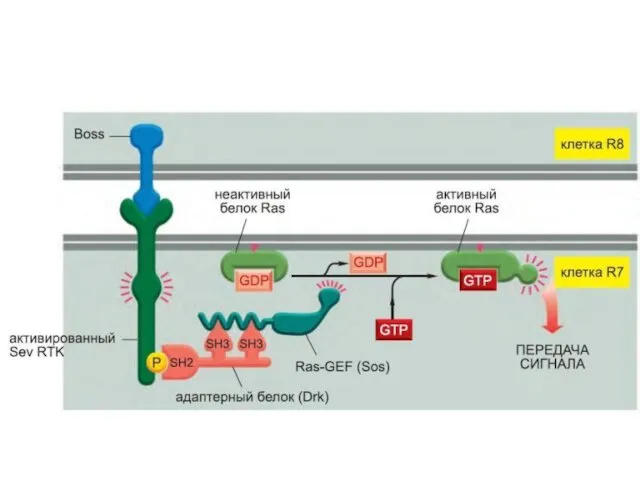
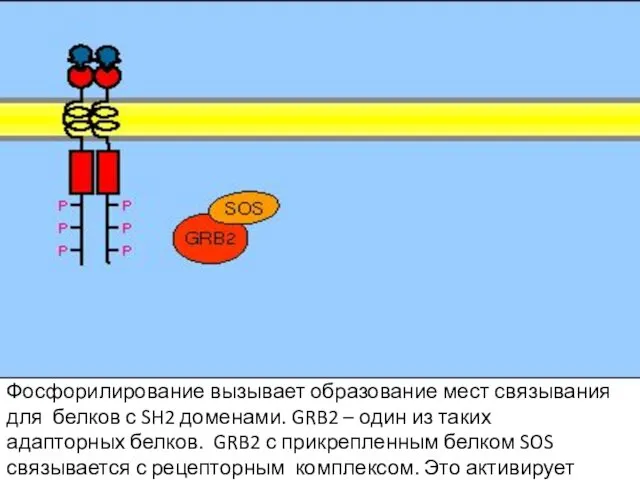
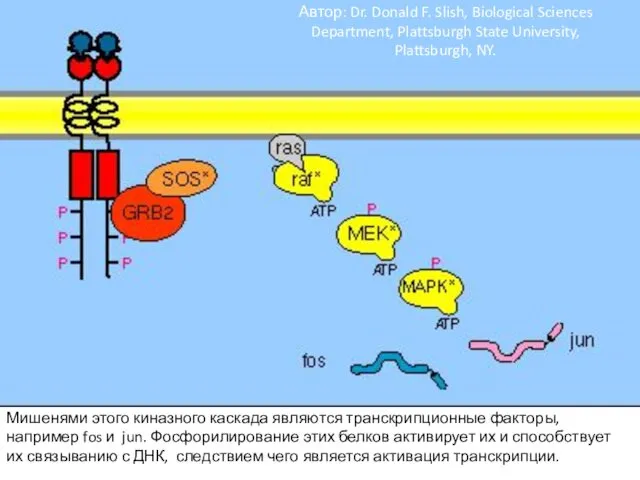
- 105. Фосфорилирование вызывает образование мест связывания для белков с SH2 доменами. GRB2 – один из таких адапторных
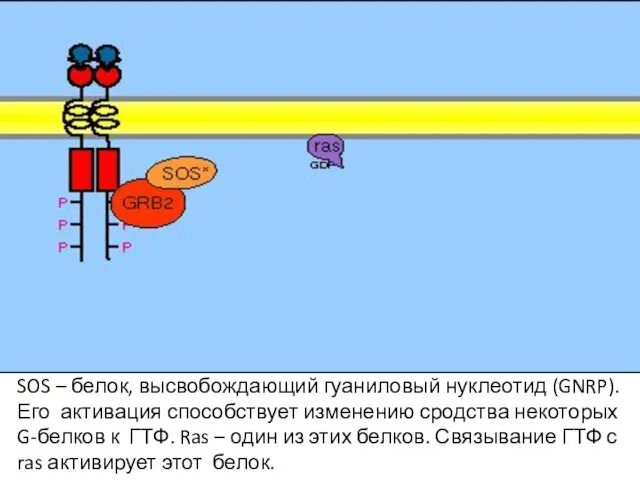
- 106. SOS – белок, высвобождающий гуаниловый нуклеотид (GNRP). Его активация способствует изменению сродства некоторых G-белков к ГТФ.
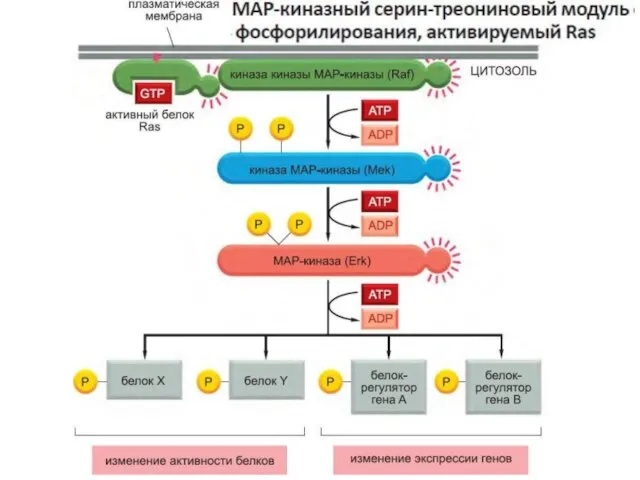
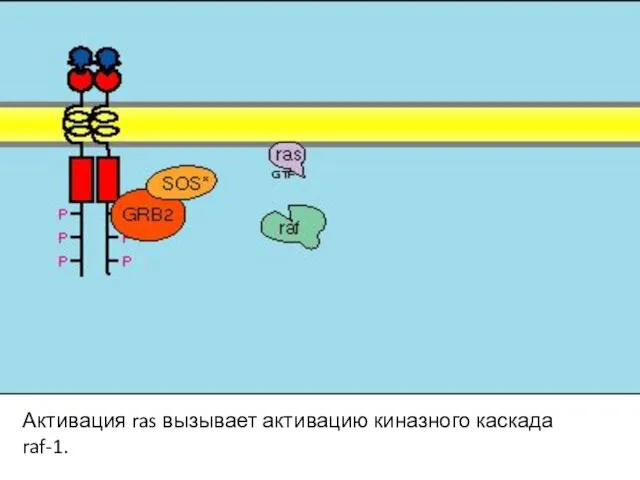
- 107. Активация ras вызывает активацию киназного каскада raf-1.
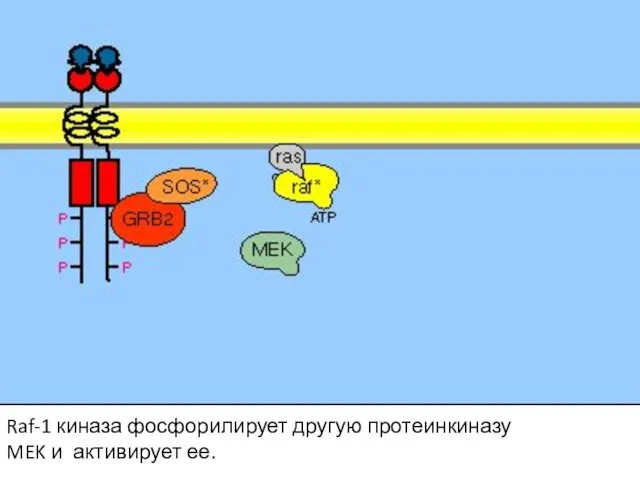
- 108. Raf-1 киназа фосфорилирует другую протеинкиназу MEK и активирует ее.
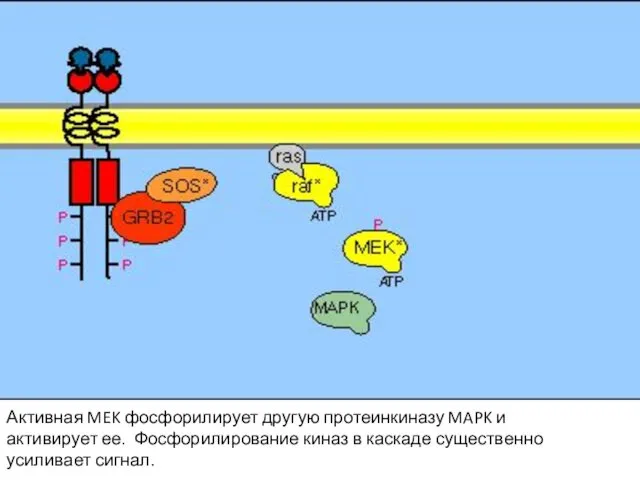
- 109. Активная MEK фосфорилирует другую протеинкиназу MAPK и активирует ее. Фосфорилирование киназ в каскаде существенно усиливает сигнал.
- 110. Мишенями этого киназного каскада являются транскрипционные факторы, например fos и jun. Фосфорилирование этих белков активирует их
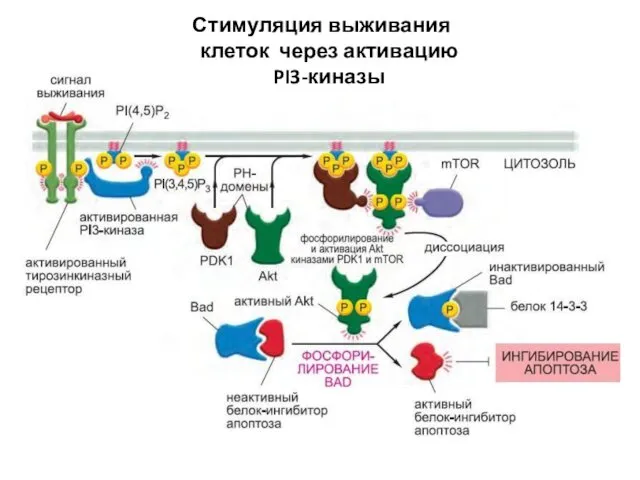
- 114. Стимуляция выживания клеток через активацию PI3-киназы
- 116. Рецепторы, сопряженные с тирозинкиназами класса Janus
- 117. Семейства рецепторов, сопряженных с JAK-киназами Семейство 1: рецепторы гормонов семейства СТГ, лептина, эритропоэтина, интерлейкинов (кроме ИЛ-10)
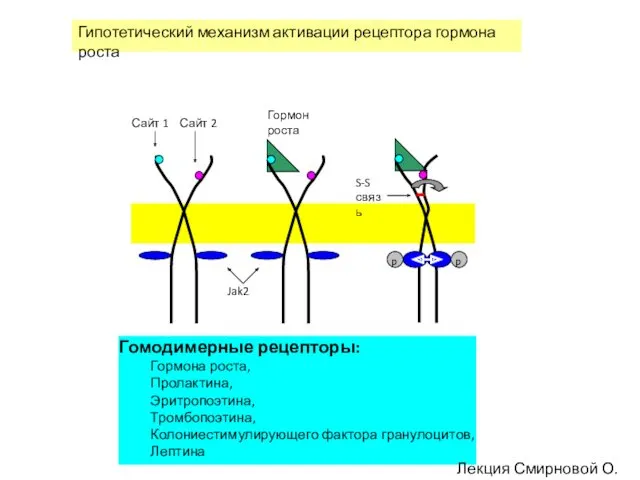
- 118. Сайт 1 Сайт 2 S-S связь Jak2 Гипотетический механизм активации рецептора гормона роста Гомодимерные рецепторы: Гормона
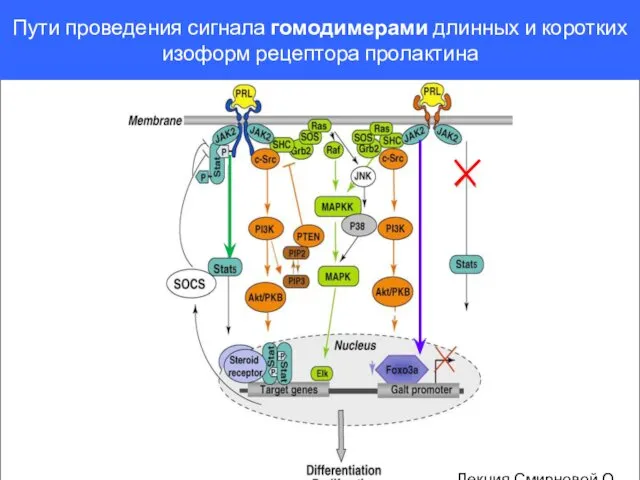
- 119. Пути проведения сигнала гомодимерами длинных и коротких изоформ рецептора пролактина Лекция Смирновой О.В.
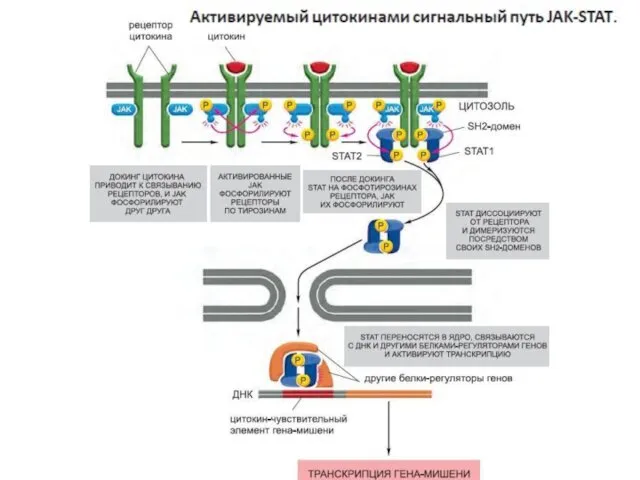
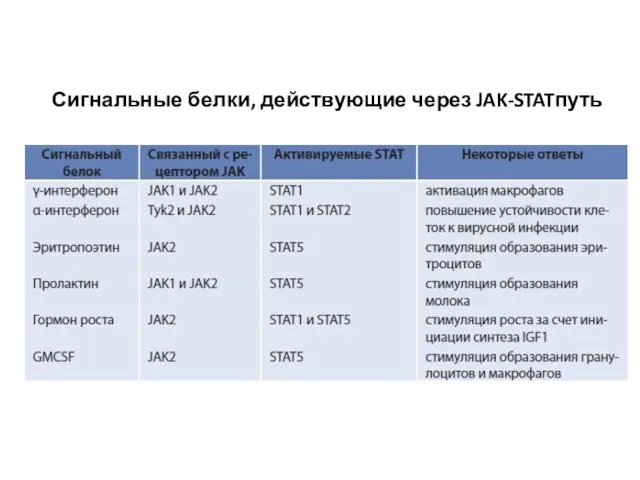
- 121. Сигнальные белки, действующие через JAK-STATпуть
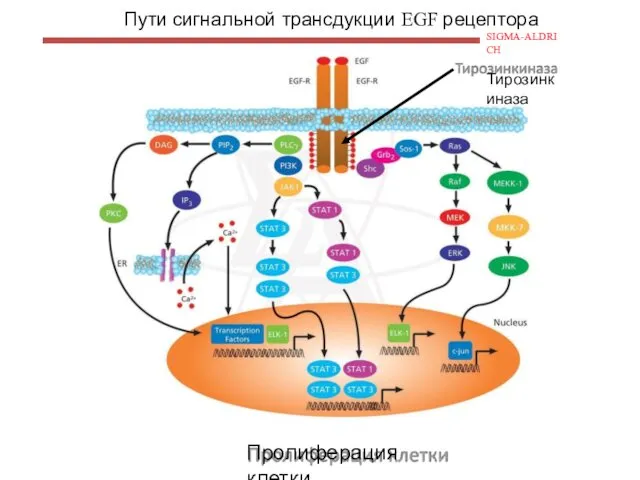
- 122. Пути сигнальной трансдукции EGF рецептора SIGMA-ALDRICH Тирозинкиназа Пролиферация клетки
- 124. Скачать презентацию






























 Презентация опасности в горах
Презентация опасности в горах Методология и методы педагогических исследований
Методология и методы педагогических исследований Вятский край. Видные люди Вятской земли.
Вятский край. Видные люди Вятской земли. Фрагмен урока ОРКСЭ.
Фрагмен урока ОРКСЭ. P770 disassembly guide
P770 disassembly guide праздник Осени во 2 классе
праздник Осени во 2 классе Дорожная и землеройная техника. Машины разграждения. Тема № 5. Занятие № 3
Дорожная и землеройная техника. Машины разграждения. Тема № 5. Занятие № 3 Обобщение инновационного педагогического опыта по теме: Использование здоровьесберегающих технологий при развитии певческих навыков у детей дошкольного возраста
Обобщение инновационного педагогического опыта по теме: Использование здоровьесберегающих технологий при развитии певческих навыков у детей дошкольного возраста Фосфор
Фосфор Презентация Математический тест.
Презентация Математический тест. Метод расчета по предельным состояниям
Метод расчета по предельным состояниям Болат өндірісіндегі суды өңдеу
Болат өндірісіндегі суды өңдеу Возникновение искусства и религиозных верований
Возникновение искусства и религиозных верований ОЦЕНКА И ОТМЕТКА СОВРЕМЕННОЙ ШКОЛЕ презентация к докладу
ОЦЕНКА И ОТМЕТКА СОВРЕМЕННОЙ ШКОЛЕ презентация к докладу Общая теория права. Понятие правоотношений
Общая теория права. Понятие правоотношений видео-презентация, посвященная 700-летию Сергия Радонежского
видео-презентация, посвященная 700-летию Сергия Радонежского Техническая эксплуатация устройств сигнализации, централизации и блокировки железнодорожного транспорта
Техническая эксплуатация устройств сигнализации, централизации и блокировки железнодорожного транспорта Литература 20-х гг. 20 века
Литература 20-х гг. 20 века Числовые и буквенные выражения и их значения
Числовые и буквенные выражения и их значения Что такое вирусы
Что такое вирусы Ядерная катастрофа на атомной электростанции Фукусима-1
Ядерная катастрофа на атомной электростанции Фукусима-1 Этой славе забвения нет живая книга памяти участников войны
Этой славе забвения нет живая книга памяти участников войны пищевые добавки
пищевые добавки Электрорадиоэлементы и электронные узлы
Электрорадиоэлементы и электронные узлы Өсімдіктер мен микроорганизмдердің қарымқатнасы
Өсімдіктер мен микроорганизмдердің қарымқатнасы Музыкально-дидактические игры
Музыкально-дидактические игры Ырғақ бұзылыстары
Ырғақ бұзылыстары Неделя : Добра
Неделя : Добра