Содержание
- 2. ВОПРОСЫ: формулировка периодического закона , данная Д.И.Менделеевым, и современная; в чем различие? строение атома физический смысл
- 3. ЭЛЕКТРОНЫ В АТОМЕ ОРБИТАЛЬ ( электронное облако) - область пространства вокруг ядра, где нахождение электрона наиболее
- 7. ЭЛЕКТРОНЫ В АТОМЕ Движение электрона в атоме описывается законами квантовой механики. Электроны вращаются вокруг ядра со
- 8. ↑ ↑↓
- 9. ↑ ↑ ↑ ↓ ↓ ↓
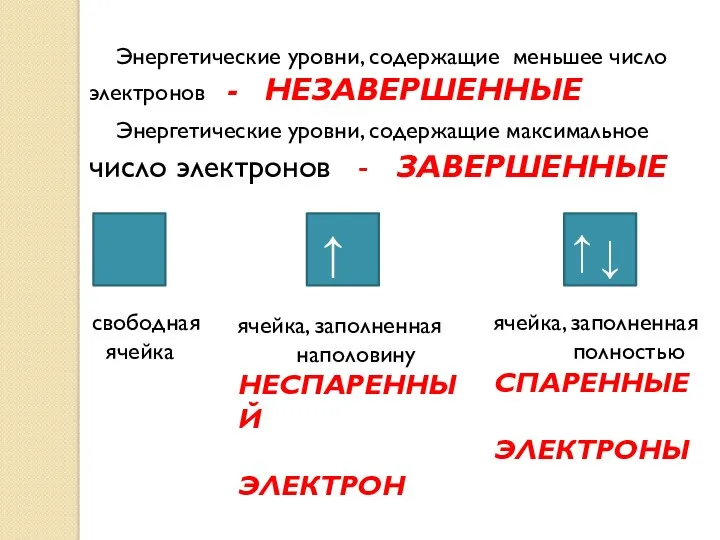
- 10. Энергетические уровни, содержащие меньшее число электронов - НЕЗАВЕРШЕННЫЕ Энергетические уровни, содержащие максимальное число электронов - ЗАВЕРШЕННЫЕ
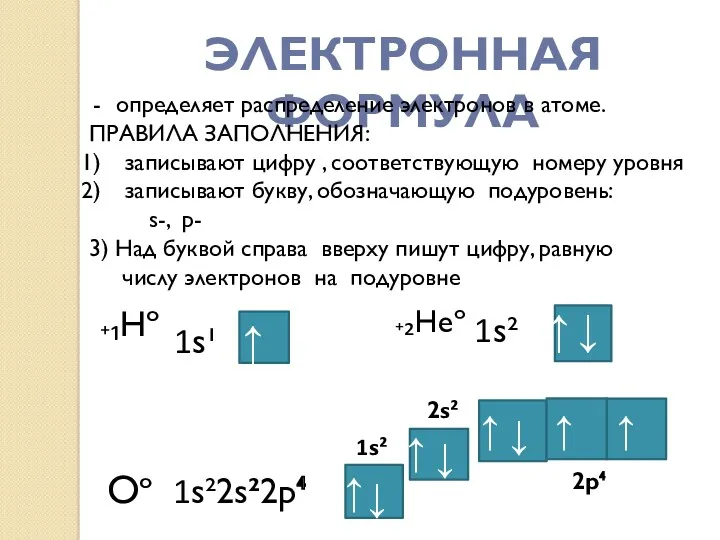
- 11. ЭЛЕКТРОННАЯ ФОРМУЛА определяет распределение электронов в атоме. ПРАВИЛА ЗАПОЛНЕНИЯ: записывают цифру , соответствующую номеру уровня записывают
- 12. Электронная конфигурация элементов 1-го периода ₊₁H )₁ 1s¹ ₊₂He)₂ 1s² Электронная конфигурация элементов 2-го периода ₊₃Li)₂)₁
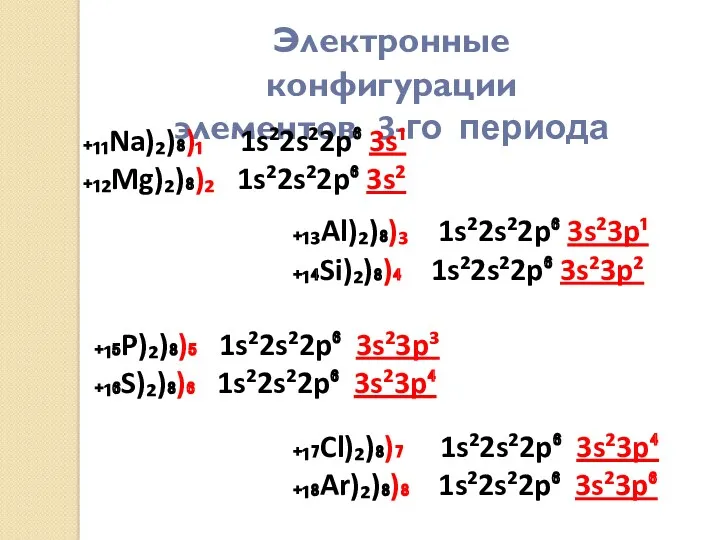
- 14. Напишите электронные формулы элементов третьего периода
- 15. Электронные конфигурации элементов 3-го периода ₊₁₁Na)₂)₈)₁ 1s²2s²2p⁶ 3s¹ ₊₁₂Mg)₂)₈)₂ 1s²2s²2p⁶ 3s² ₊₁₃Al)₂)₈)₃ 1s²2s²2p⁶ 3s²3p¹ ₊₁₄Si)₂)₈)₄ 1s²2s²2p⁶
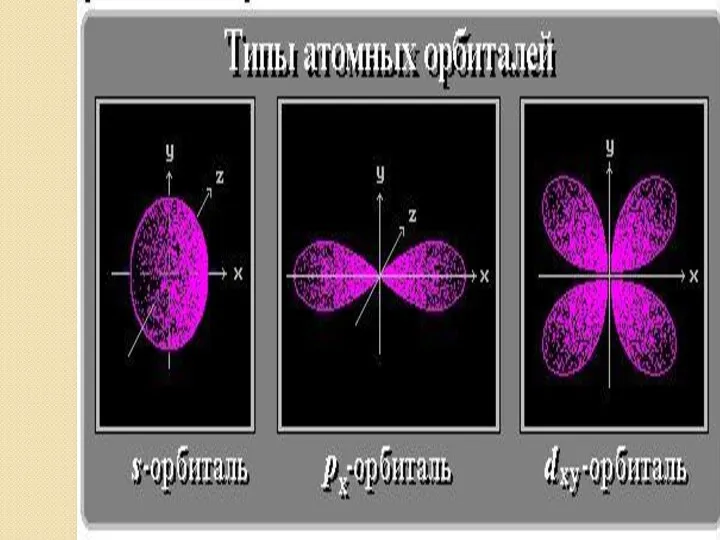
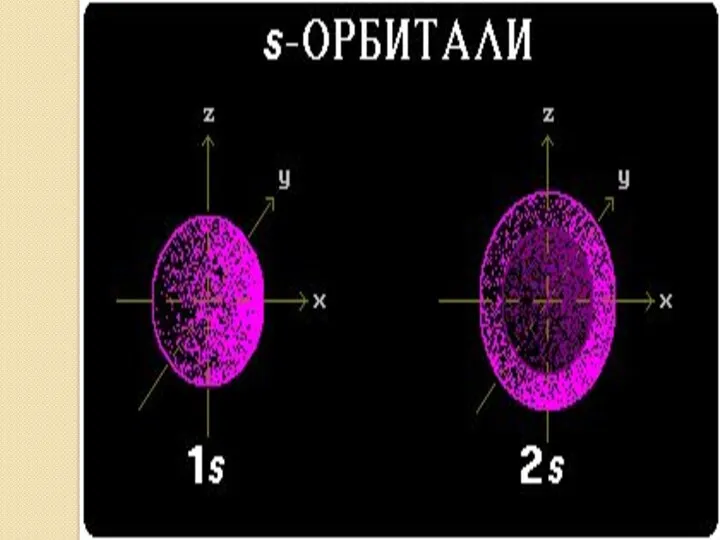
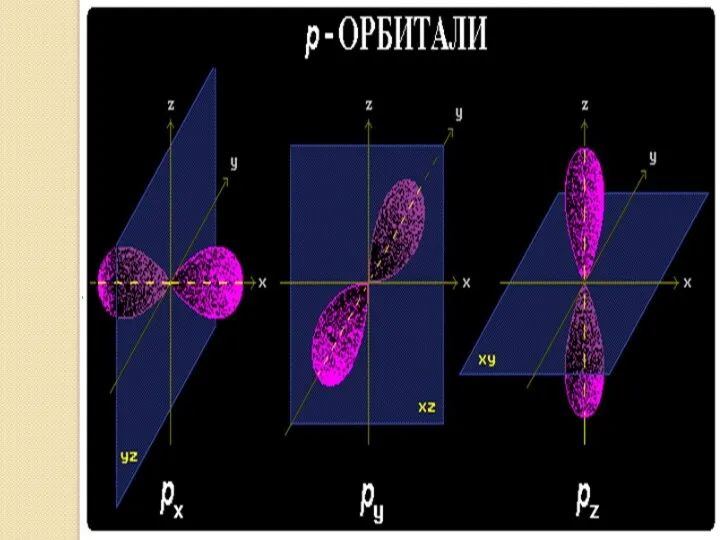
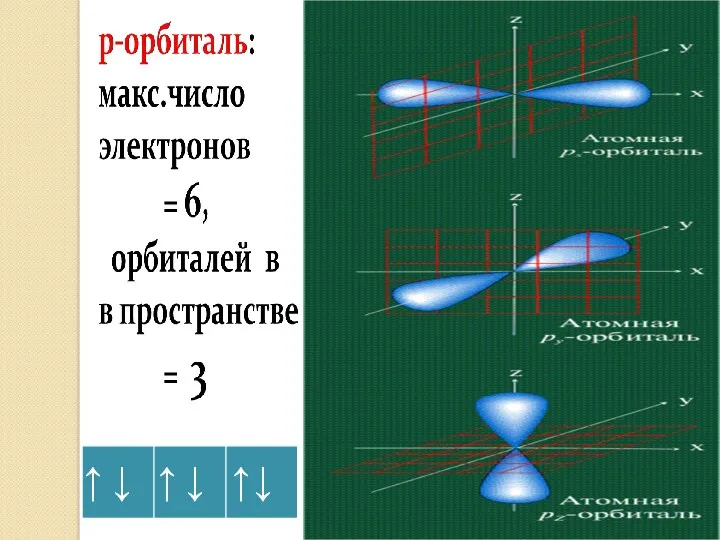
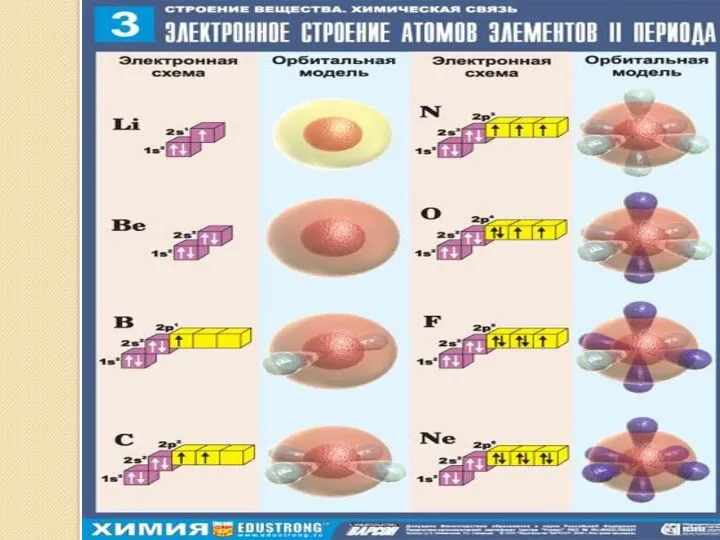
- 16. ВЫВОДЫ: В зависимости от энергии электронные облака различаются формой и размерами. s – орбиталь: - сферическая
- 17. Т Е С Т Магний расположен в одной группе с: а) бором б) кальцием в) натрием
- 18. 5. Химические элементы алюминий и хлор расположены: а) в разных периодах, но одной группе б) в
- 19. 10. Определите число энергетических слоев вокруг ядра атома водорода - H: а) 2 б) 1 в)
- 21. Скачать презентацию










 Урок Мужества Женя Табаков
Урок Мужества Женя Табаков Найди своего героя
Найди своего героя Целеполагание на уроке биологии
Целеполагание на уроке биологии Сказки про усатых-полосатых
Сказки про усатых-полосатых Исследование темы История моей семьи
Исследование темы История моей семьи ЛЕГО - конструирование – модная игра или серьёзное занятие?
ЛЕГО - конструирование – модная игра или серьёзное занятие? Стандарты и нормы. Юридические (правовые) аспекты УП
Стандарты и нормы. Юридические (правовые) аспекты УП Презентация День Знаний
Презентация День Знаний Реформы 1860–1870 годов в России, их последствия и значение
Реформы 1860–1870 годов в России, их последствия и значение А. Барто - поэзия доброты
А. Барто - поэзия доброты Альтернативные источники энергии. Ветроэнергетика
Альтернативные источники энергии. Ветроэнергетика Кого направить к кардиологу
Кого направить к кардиологу ФГОС НОО второго поколения
ФГОС НОО второго поколения Первый в Ижевске бассейн премиум класса для детей от рождения до 7 лет
Первый в Ижевске бассейн премиум класса для детей от рождения до 7 лет День открытых дверей в ТОГБПОУ Тамбовский областной медицинский колледж
День открытых дверей в ТОГБПОУ Тамбовский областной медицинский колледж Сервировка стола для кофе
Сервировка стола для кофе Изготовление Деда Мороза из бумаги
Изготовление Деда Мороза из бумаги Животный мир Австралии
Животный мир Австралии Территориальный маркетинг в системе регионального управления
Территориальный маркетинг в системе регионального управления Основы гражданского права
Основы гражданского права Международные экономические и финансовые организации
Международные экономические и финансовые организации Презентация Что такое наблюдение? Виды педагогических наблюдений.Алгоритм действия педагога при наблюдении..
Презентация Что такое наблюдение? Виды педагогических наблюдений.Алгоритм действия педагога при наблюдении.. Система контроля и управления доступом Сфинкс Школа
Система контроля и управления доступом Сфинкс Школа Шумы в усилительных каскадах
Шумы в усилительных каскадах Солнечная система. Интерактивный тест Диск
Солнечная система. Интерактивный тест Диск Мочевыделительная система
Мочевыделительная система Классный час
Классный час Для тех, кто влюблен в аккордеон.
Для тех, кто влюблен в аккордеон.