Содержание
- 2. ЛЕКЦИЯ №4 РАСТВОРЫ И РАСТВОРИМОСТЬ ВЕЩЕСТВ И ГАЗОВ В ВОДЕ ОП. 05 Химия 1 курс 1
- 3. Виды дисперсных систем Дисперсная система - это система, когда одно вещество мелко раздроблено в другом веществе.
- 4. Дисперсионная среда (молекла воды)
- 5. Виды дисперсных систем По агрегатному состоянию различают: газовые системы (воздух); твердые системы (сплавы металлов); жидкие (дисперсионная
- 6. Виды дисперсных систем Твердая или жидкая гомогенная система состоящая из 2-х или более компонентов называется раствором.
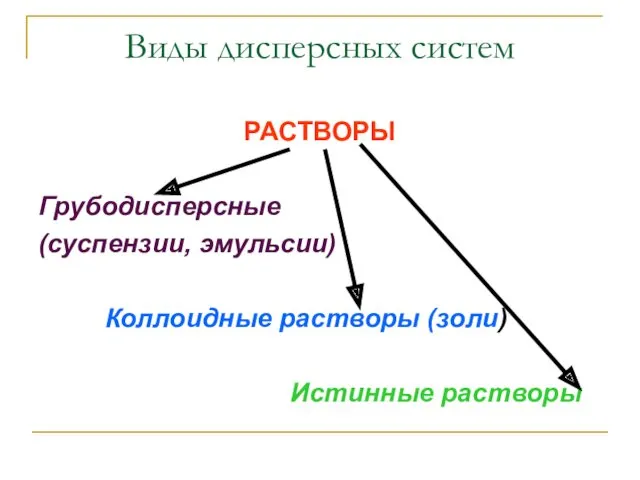
- 7. Виды дисперсных систем РАСТВОРЫ Грубодисперсные (суспензии, эмульсии) Коллоидные растворы (золи) Истинные растворы
- 8. Виды дисперсных систем В зависимости от размера растворенных частиц выделяют: 1. Грубодисперсные системы: суспензии - дисперсная
- 9. Виды дисперсных систем 2. Коллоидные растворы (золи) - состоят из частиц очень малого размера (10-5 -
- 10. Виды дисперсных систем 3. Истинные растворы - растворы, в которых частицы не могут быть обнаружены оптическим
- 11. Истинные растворы
- 12. Растворимость веществ Растворимость - свойство веществ растворяться в воде или других растворителях. Мера растворимости - число
- 13. Растворимость веществ Растворы готовят: насыщенные - раствор, содержащий максимально возможное количество растворенного вещества при данных условиях;
- 14. Растворимость веществ пересыщенные- раствор, содержащий при данных условиях больше растворенного вещества, чем в насыщенном растворе, избыток
- 15. Твердые вещества по растворимости делятся на легко растворимые - в 100 г воды при комнатной температуре
- 16. Растворение веществ сопровождается: выделением теплоты (положительный тепловой эффект) поглощением теплоты (отрицательный тепловой эффект) и изменением объема.
- 17. Вывод: Растворение - процесс химического и физического взаимодействия растворенного вещества и растворителя (гидратная теория Д. И.
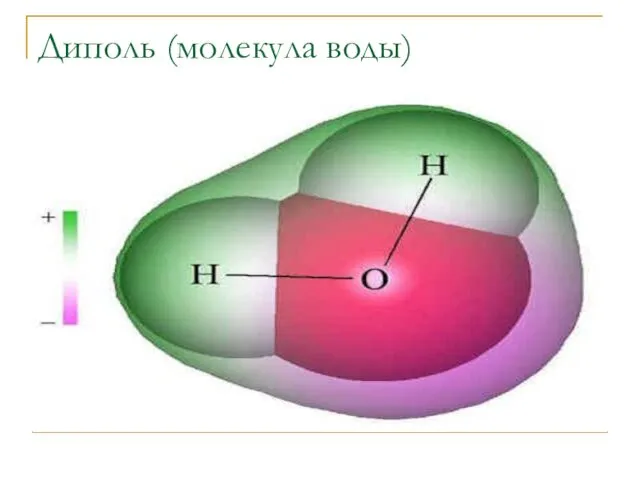
- 18. Диполь (молекула воды)
- 19. Растворение веществ Если при растворении твердого вещества выделяется тепло, растворимость такого вещества уменьшается с повышением температуры.
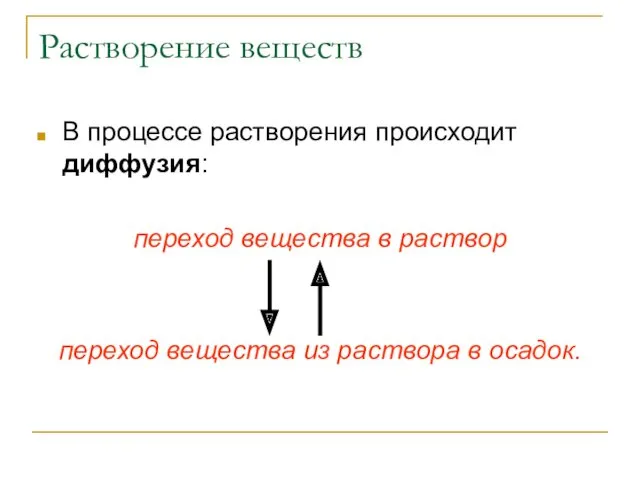
- 20. Растворение веществ В процессе растворения происходит диффузия: переход вещества в раствор переход вещества из раствора в
- 21. Растворение веществ При растворении частицы растворяемого вещества образуют с молекулами растворителя нестойкие, имеющие переменный состав соединения,
- 22. Растворимость газа Растворимость газа - это число показывающее, сколько объемов его растворяется в одном объеме жидкости
- 23. Растворимость газа При повышении температуры растворимость газов в воде уменьшается (кипячением воды удаляются газы). Растворимость газа
- 24. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
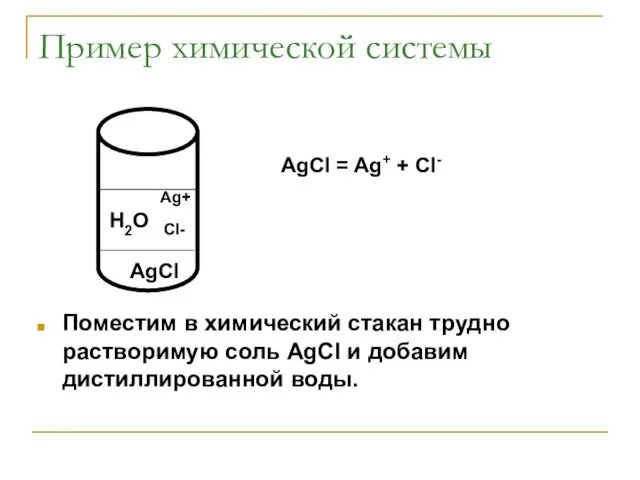
- 25. Пример химической системы Поместим в химический стакан трудно растворимую соль AgCl и добавим дистиллированной воды. AgCl
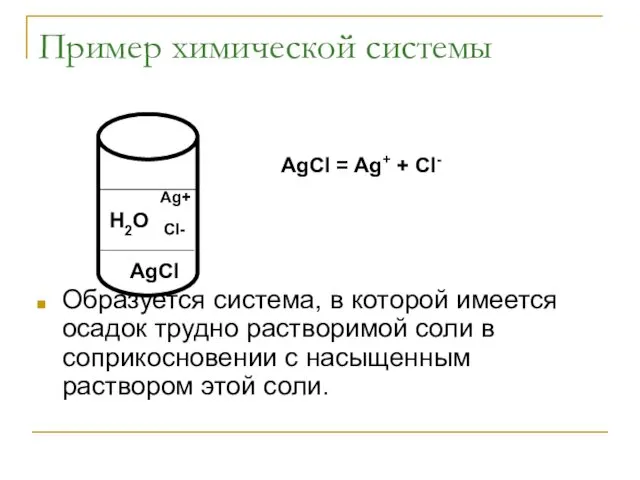
- 26. Пример химической системы Образуется система, в которой имеется осадок трудно растворимой соли в соприкосновении с насыщенным
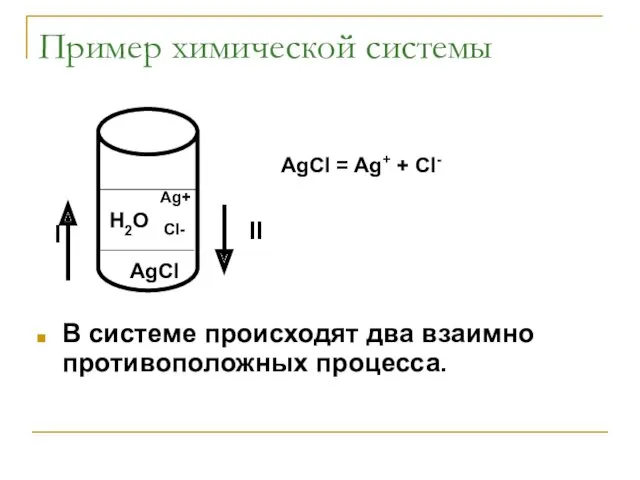
- 27. Пример химической системы В системе происходят два взаимно противоположных процесса. AgCl H2O AgCl = Ag+ +
- 28. I Переход ионов из осадка в раствор: Скорость процесса пропорциональна числу ионов, находящихся на единице поверхности
- 29. I Переход ионов из осадка в раствор: Скорость процесса равна: V1 = k1 k1 - это
- 30. II Осаждение ионов из раствора: Скорость этого процесса пропорциональна концентрации ионов Ag+ и Cl- в растворе.
- 31. II Осаждение ионов из раствора: V2 = k2 х [Ag+][Cl-] где k2 - коэффициент пропорциональности -
- 32. Равновесие системы Система находится в состоянии равновесия: V1 = V2, отсюда k1 = k2 х[Ag+][Cl-] или
- 33. Равновесие системы Из равенства вытекает: произведение концентраций ионов в насыщенном растворе есть величина постоянная и называется
- 34. Определение ПР Произведение концентраций ионов в насыщенном растворе труднорастворимого электролита является постоянной величиной при постоянной температуре
- 35. Образование осадков Изменяя концентрации ионов в насыщенном растворе, можно нарушить равновесие и вызвать осаждение или растворение
- 36. Образование осадков Осадок образуется в том случае, когда произведение концентраций ионов малорастворимого электролита превысит ПР электролита
- 37. Образование осадков Влияние концентрации растворов. Влияние количества осадителя. Влияние одноименного иона. Влияние температуры.
- 38. Образование осадков Влияние количества осадителя. Для полного осаждения используют избыток осадителя ( в количестве не более
- 39. Образование осадков [Ba2+][CO32-] > ПРBaCO3 увеличивается концентрация [CO32-] и все произведение; происходит более полное осаждение.
- 40. Образование осадков Влияние одноименного иона. Растворимость труднорастворимых электролитов понижается в присутствии других сильных электролитов, имеющих одноименный
- 41. Образование осадков Влияние температуры. С увеличением температуры ПР возрастает, поэтому осаждение проводят из холодных растворов.
- 42. Растворение осадков Растворение осадка начинается когда ионное произведение малорастворимого электролита станет меньше величины ПР. Чтобы растворить
- 43. Растворение осадков Требуется растворить осадок Mg(OH)2 при условии [Mg2+][OH-]2 = ПРMg(OH)2 Mg(OH)2 ↔ Mg2+ + 2OH-
- 44. Солевой эффект Растворимость повышается в присутствии солей, не имеющих одноименного иона. Эти ионы мешают ионам труднорастворимой
- 46. Скачать презентацию






















![II Осаждение ионов из раствора: V2 = k2 х [Ag+][Cl-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/57419/slide-30.jpg)







![Образование осадков [Ba2+][CO32-] > ПРBaCO3 увеличивается концентрация [CO32-] и все произведение; происходит более полное осаждение.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/57419/slide-38.jpg)



![Растворение осадков Требуется растворить осадок Mg(OH)2 при условии [Mg2+][OH-]2 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/57419/slide-42.jpg)

 Основной капитал и его роль в производстве
Основной капитал и его роль в производстве Обеспечение анестезиологического пособия при операциях на печени
Обеспечение анестезиологического пособия при операциях на печени Видеоряд к уроку этики Добро и зло
Видеоряд к уроку этики Добро и зло Мой прадед участник ВОВ
Мой прадед участник ВОВ Задачі на рівняння по хімії (7 клас)
Задачі на рівняння по хімії (7 клас) Диагностика и лечение глаукомы
Диагностика и лечение глаукомы Отчет за июль 2015. ProStor
Отчет за июль 2015. ProStor Презентация Развитие мышления младших школьников
Презентация Развитие мышления младших школьников Сарайкина Н. Рекультивация нефтезагрязненных почв
Сарайкина Н. Рекультивация нефтезагрязненных почв Анимационная открытка к Новому 2015 году. Диск
Анимационная открытка к Новому 2015 году. Диск Приглашение на конференцию Ассоциации Юных Лидеров
Приглашение на конференцию Ассоциации Юных Лидеров СП Ветошкиной К.А. 37 группа
СП Ветошкиной К.А. 37 группа Основы православной культуры. Христианская семья
Основы православной культуры. Христианская семья Культура Беларуси
Культура Беларуси Биполярные транзисторы. Устройство, классификация и принцип действия
Биполярные транзисторы. Устройство, классификация и принцип действия презентация родительского собрания
презентация родительского собрания Образовательная деятельность в разновозрастном детском сообществе Светлячок (Центр развития ребёнка - детский сад № 5 Колокольчик города Белёв Тульской области)
Образовательная деятельность в разновозрастном детском сообществе Светлячок (Центр развития ребёнка - детский сад № 5 Колокольчик города Белёв Тульской области) Группы крови по системе AB0
Группы крови по системе AB0 Равнобедренный треугольник
Равнобедренный треугольник Главные параметры карьера
Главные параметры карьера Организация производства на предприятиях общественного питания
Организация производства на предприятиях общественного питания Авиастроение и авиационный транспорт
Авиастроение и авиационный транспорт Геоморфология. Факторы рельефообразования
Геоморфология. Факторы рельефообразования Развивающая игра кто где живет? для детей от 2.5 лет.
Развивающая игра кто где живет? для детей от 2.5 лет. Электронный задачник по генетике. Часть 2
Электронный задачник по генетике. Часть 2 Clothes
Clothes Computer System Overview
Computer System Overview Головоломка пентамино
Головоломка пентамино