Содержание
- 2. Если ты, придя с мороза, Наливаешь крепкий чай, Хорошенько сахарозу В чашке ложкой размешай.
- 3. Задача Бабушка внукам на завтрак приготовила чай, один попросил положить в стакан две чайные ложки сахара,
- 4. Вопросы Что Вы понимаете под словосочетанием «Сладкий чай» с точки зрения химии? Почему Вы не можете
- 5. Тема: Растворы. Вычисления массовой доли растворенного вещества в растворе.
- 6. Цель: Формирование знаний о растворах, массовой доли растворенного вещества
- 7. План урока: Вспомнить, что мы уже знаем по этой теме? Узнать, как найти содержание растворенного вещества
- 8. О чём идёт речь в задаче, поставленной в начале урока? Что же такое чай с сахаром
- 9. Что такое раствор? Растворы – это однородные системы, состоящие из молекул растворителя и частиц растворенного вещества,
- 10. Как образуется раствор?
- 11. Взвеси, в которых мелкие капельки какой-либо жидкости равномерно распределены между молекулами воды, называют эмульсиями. Взвеси, в
- 12. Растворимость веществ в воде Вещества хорошо растворимые (в 100г H2O больше 1г вещества) нерастворимые (в 100г
- 13. Растворимость Способность вещества образовывать с другими веществами (растворителями) однородные системы – растворы Зависит: От природы растворяемого
- 14. Растворимость. Растворы Коэффициент растворимости – это масса вещества (г), способная раствориться в одном литре растворителя (л)
- 15. Узнайте как найти содержание растворенного вещества в растворе, количественные данные для решения задачи. «В каком стакане
- 16. продолжите предложения Раствор состоит из… Растворителем может быть… Для того, чтобы приготовить раствор заданной концентрации необходимо
- 17. РАСТВОРЫ Разбавленные Концентрированные Если в определенном объеме раствора содержится мало растворенного вещества Если в определенном объеме
- 18. Как выражают содержание вещества в растворе? Содержание вещества в растворе часто выражают в массовых долях.
- 19. Что такое массовая доля растворенного вещества? Отношение массы растворенного вещества к массе раствора называют массовой долей
- 20. Физминутка
- 21. Решение задач В 513 грамм дистиллированной воды растворили 20 грамм соли. Вычислите массовую долю растворенного вещества
- 22. Домашнее задание: § 33,34 прочитать Тестовые задания страница 113, 117. Задачи №5, 7 на странице 117
- 23. Я узнал… Я знаю… Я могу… Вызвало затруднение… Мне это пригодится…
- 25. Скачать презентацию






















 Фінансове право України. Бюджетне право
Фінансове право України. Бюджетне право Урок химии Дифференцированные задания
Урок химии Дифференцированные задания Simple complicated sentences. Sentence Types
Simple complicated sentences. Sentence Types Пожарная безопасность автозаправочных станций
Пожарная безопасность автозаправочных станций Электрические методы
Электрические методы Скульпту́ра. Объект изображения в скульптуре
Скульпту́ра. Объект изображения в скульптуре Разные типы занятий и их роль в экологическом воспитании детей
Разные типы занятий и их роль в экологическом воспитании детей Особенности проектирования ситуаций действия в деловой игре
Особенности проектирования ситуаций действия в деловой игре Води суходолу Африки. Головні річкові системи, озера, підземні води і їх гідрологічні особливості
Води суходолу Африки. Головні річкові системи, озера, підземні води і їх гідрологічні особливості Правила поведения пассажира в личном транспорте
Правила поведения пассажира в личном транспорте Растительный и животный мир Ростовской области
Растительный и животный мир Ростовской области Види і функції сучасних медіа
Види і функції сучасних медіа Музыка XVIII-XIX веков
Музыка XVIII-XIX веков Физические качества
Физические качества Действия с информацией
Действия с информацией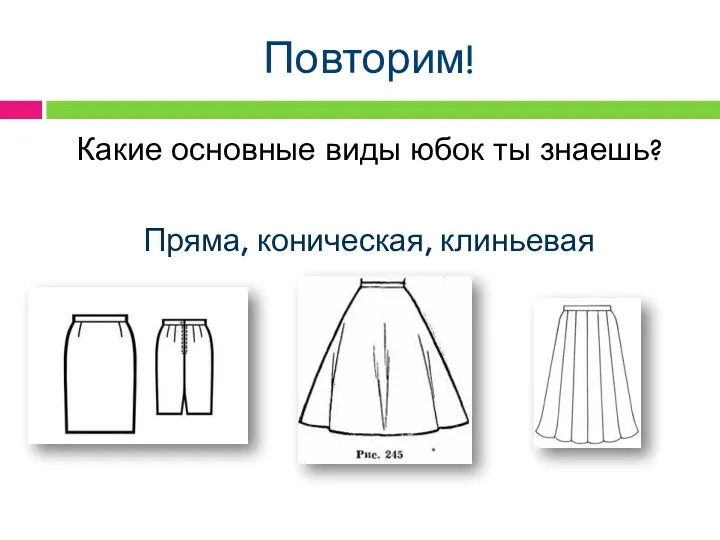 Раскрой юбки
Раскрой юбки Науково-методичні засади аналізу художнього тексту як явища художнього стилю (на прикладі вивчення літератури модернізму)
Науково-методичні засади аналізу художнього тексту як явища художнього стилю (на прикладі вивчення літератури модернізму) Рельефа Земли. Равнины
Рельефа Земли. Равнины Моя семья. Екатерина Багринцева
Моя семья. Екатерина Багринцева Применение производной для решения задач ЕГЭ (задание В8)
Применение производной для решения задач ЕГЭ (задание В8) Всемирный фонд дикой природы WWF
Всемирный фонд дикой природы WWF Презентация Русская народная кукла
Презентация Русская народная кукла Синдром Стилла
Синдром Стилла Профориентационная игра Перспектива успеха
Профориентационная игра Перспектива успеха Модель компактного городского автомобиля на базе конструктора Lego We Do 2.0
Модель компактного городского автомобиля на базе конструктора Lego We Do 2.0 Опричнина Ивана Грозного в 1565-1572 годы и ее последствия
Опричнина Ивана Грозного в 1565-1572 годы и ее последствия Развитие географических знаний о Земле
Развитие географических знаний о Земле Что может быть семьи дороже
Что может быть семьи дороже